דברים שחשוב לשנן
-
ממס פולארי אַפרוטי - מתאים לתגובות $\mathrm{S_N2}$.
- $\ce{CH3COCH3}$ (אצטון), $\ce{THF}$, $\ce{DMSO}$.
-
ממס פולארי פרוטי - מייצב קרבוקטיונים, מתאים לתגובות $\mathrm{S_N1}$.
-
$\ce{H2O}$, $\ce{CH3OH}$ מתנול, $\ce{CH3COOH}$, $\ce{NH3}$.
-
$\ce{CH3OH}$ (מתנול) - ממס פולארי פרוטי ונוקלאופיל חלש.
-
טבלת החלטות להתמרה ואלימינציה
| תנאי תגובה / סובסטרט | $1^\circ$ | $2^\circ$ | $3^\circ$ | מתיל $\ce{CH3X}$ |
|---|---|---|---|---|
| בסיס חזק נוקלאופיל חזק ($\ce{OH-}$, $\ce{RO-}$) | $\mathrm{S_N2}$ (עיקרי) + מעט E2 | E2 (עיקרי) + מעט $\mathrm{S_N2}$ | E2 בלבד (נדרש אנטי-סטאגרד) | $\mathrm{S_N2}$ בלבד |
| בסיס חזק נוקלאופיל חזק גדול ונפחי ($\ce{tert-BuO-}$) | E2 (עיקרי) + מעט $\mathrm{S_N2}$ | E2 (הופמן עיקרי) | E2 | $\mathrm{S_N2}$ בלבד |
| בסיס חלש נוקלאופיל חזק ($\ce{F-}$, $\ce{CN-}$) | $\mathrm{S_N2}$ | $\mathrm{S_N2}$ | $\mathrm{S_N1}$ | $\mathrm{S_N2}$ בלבד |
| בסיס חלש נוקלאופיל חלש ($\ce{ROH}$, $\ce{H2O}$) | $\mathrm{S_N2}$ (איטי מאוד) | $\mathrm{S_N1}$/E1 ממס פולרי פרוטי | $\mathrm{S_N1}$ וגם E1 | $\mathrm{S_N2}$ (איטי) |
| תוצר עיקרי | התמרה (בד”כ) | תלוי בתנאים | אלימינציה (בד”כ) | התמרה תמיד |
הערות:
- חימום (Δ) מעודד אלימינציה בכל המקרים
- ממס פולרי אַפרוטי (אצטון, DMSO) מעודד $\mathrm{S_N2}$
- ממס פולרי פרוטי (מים, אלכוהול) מעודד $\mathrm{S_N1}$/E1
בסיס חזק נוקלאופיל חזק: \(\ce{NaOCH2CH3}, \ce{KOC(CH3)3}, \ce{NaNH2}, \ce{NaOCH3}\)
- $\ce{OH-}$ Hydroxide
- $\ce{RO-}$ Alkoxide, including $\ce{CH3O-}$ (Methoxide) and $\ce{C2H5O-}$ (Ethoxide)
- $\ce{NH2-}$ Amide
- Bulky bases like $\ce{tert-BuO-}$ (tert-butoxide) that favor elimination
גדול ונפחי:
נקוקלאופיל חזק בסיס חלש (בפחמן ראשוני ושניוני-$\mathrm{S_N2}$): \(\ce{CN-}, \ce{Br-}, \ce{I-}, \ce{SH-}, \ce{SR-}, \ce{N3-}, \ce{CH3COO-}, \ce{SH2}, \ce{RSH}, \ce{NRH2}\)
בסיס חלש נוקלאופיל חלש:
\[\ce{H2O}, \ce{CH3OH}, \ce{CH3CH2OH}\]
 |  |
תוצרים
| תוצר $\mathrm{S_N2}$ | תוצר $\mathrm{S_N1}$ | תוצר E2 | תוצר E1 |
|---|---|---|---|
| רק מסוג אחד (אם יש פחמן כיראלי ← היפוך קונפיגורציה) | אם יש פחמן כיראלי ← תערובת אננטיומרים (רצמיזציה) | תוצר ספציפי (תלוי בגיאומטריה של החומר המתחיל ובדרישת אנטי-פריפלנרי) | תערובת איזומרים גיאומטריים (E/Z או cis/trans) בדרך כלל האיזומר היציב יותר |
הסברים
-
$\mathrm{S_N2}$: מנגנון חד-שלבי עם היפוך קונפיגורציה במרכז כיראלי
-
$\mathrm{S_N1}$: מנגנון דו-שלבי דרך קרבוקטיון מישורי ← רצמיזציה
-
E2: מנגנון חד-שלבי עם דרישה גיאומטרית אנטי-פריפלנרי ← תוצר ספציפי
-
E1: מנגנון דו-שלבי דרך קרבוקטיון מישורי ← תערובת איזומרים גיאומטריים
גורמי השפעה על מהירות תגובות התמרה (Substitution Reaction Rates)
| גורם | $\mathrm{S_N2}$ | $\mathrm{S_N1}$ | הסבר |
|---|---|---|---|
| סוג הסובסטרט | מתיל > 1° > 2° ≫ 3° | 3° > 2° > 1° > מתיל | ב-$\mathrm{S_N1}$: יציבות קרבוקטיון קובעת ב-$\mathrm{S_N2}$: הפרעה סטרית קובעת |
| חוזק נוקלאופיל | השפעה מכרעת $\ce{I^- > CN^- > OH^- > H2O}$ | השפעה מינימלית | ב-$\mathrm{S_N2}$: נוקלאופיל חזק = תגובה מהירה ב-$\mathrm{S_N1}$: תוקף רק אחרי שלב קובע מהירות |
| קבוצה עוזבת | השפעה חשובה $\ce{I^- > Br^- > Cl^- > F^-}$ | השפעה קריטית $\ce{I^- > Br^- > Cl^- > F^-}$ | קבוצה עוזבת טובה = קל יותר לנתק = תגובה מהירה יותר |
| סוג ממס | פולרי אַפרוטי מאיץ $\ce{DMSO}$ העדפה במסס אפרוטי: \(\boxed{\ce{F^-} > \ce{Cl^-} > \ce{Br^-} > \ce{I^-}}\) העדפה בממס פרוטי: \(\boxed{\ce{I^-} > \ce{Br^-} > \ce{Cl^-} > \ce{F^-}}\) | פולרי פרוטי מאיץ מאוד $\ce{H2O}$ | אַפרוטי: עדיפות למולקולות קטנות פרוטי: מייצב קרבוקטיון וקבוצה עוזבת, עדיפות למולקולות גדולות ($\ce{I}$) |
| ריכוז נוקלאופיל | השפעה ישירה ולינארית | אין השפעה | $\mathrm{S_N1}$: $\text{rate} = k[\ce{RX}]$ $\mathrm{S_N2}$: $\text{rate} = k[\ce{RX}][\ce{Nu}]$ |
| הפרעה סטרית | השפעה דרמטית | מעט השפעה | כל קבוצה מתיל מפחיתה מהירות $\mathrm{S_N2}$ פי 10-100 |
| אפקטים אינדוקטיביים | קבוצות מושכות אלקטרונים מאיצות $\mathrm{S_N2}$ | קבוצות מושכות אלקטרונים מאיצות $\mathrm{S_N1}$ | הגברת אלקטרופיליות מאיצה את שתי התגובות |
| זמן תגובה | מהיר יחסית | איטי יחסית | $\mathrm{S_N1}$ מוגבל על ידי יצירת קרבוקטיון |
| השוואת מהירויות | מתיל > 1° ≫ בנזילי > אלילי > 2° ≫ 3° | בנזילי > אלילי > 3° ≫ 2° ≫ 1° | סובסטרטים בנזיליים ואליליים מוגברים ברזוננס |
הערות חשובות:
- קרבוקטיונים בנזיליים ואליליים מיוצבים מאוד ברזוננס, ולכן מהירים במיוחד ב-$\mathrm{S_N1}$
- ב-$\mathrm{S_N2}$, כל הסתעפות סביב הפחמן האלקטרופילי מקטינה את המהירות דרמטית
- ריאקציות $\mathrm{S_N1}$ עם קרבוקטיונים לא-יציבים (מתיל, 1°) כמעט בלתי אפשריות
מבוא לתגובות התמרה
נוקלאופיל ואלקטרופיל
תגובות התמרה כוללות שני רכיבים עיקריים:
- נוקלאופיל: צורון עשיר באלקטרונים
- מזוהה לרוב במטען שלילי
- נמשך למטען חיובי (“אוהב גרעין”)
- תורם אלקטרונים
- אלקטרופיל: צורון עני באלקטרונים
- “אוהב אלקטרונים”
- מחפש אלקטרונים ממקור אחר (מהנוקלאופיל)
בתגובות התמרה נוצר קשר קוולנטי בין הנוקלאופיל והאלקטרופיל.
מרכיבי תגובת התמרה
- נוקלאופיל: טעון שלילית
- סובסטרט: המצע של התגובה, המגיב המרכזי שעליו מתבצעת התגובה
- מכיל פחמן אלקטרופילי
- מכיל קבוצה עוזבת (X)
תגובת התמרה היא בעצם החלפה בין הנוקלאופיל לקבוצה העוזבת. הפחמן האלקטרופילי מזוהה בכך שהוא קשור לקבוצה עוזבת.
מנגנוני תגובות התמרה
תגובות התמרה מתרחשות בשני מנגנונים עיקריים:
\[\begin{array}{ll} \mathrm{S_N2} & \mathrm{S_N1} \\ \text{Substitution} & \text{Substitution} \\ \text{Nucleophilic} & \text{Nucleophilic} \\ \text{Bimolecular} & \text{Unimolecular} \end{array}\]ההבדל העיקרי הוא בקצב התגובה:
-
$\mathrm{S_N2}$: קצב התגובה תלוי בריכוז הסובסטרט ובריכוז הנוקלאופיל
\[\boxed{\mathrm{S_N2} \, \text{Rate} = k \times [\text{Substrate}] \times [\text{Nucleophile}]}\] -
$\mathrm{S_N1}$: קצב התגובה תלוי רק בריכוז הסובסטרט
\[\boxed{\mathrm{S_N1} \, \text{Rate} = k \times [\text{Substrate}]}\]
תגובת $\mathrm{S_N2}$
מאפייני התגובה
- תגובה מהירה
- מתרחשת בשלב אחד (קונצרטי)
- הנוקלאופיל מתקרב לפחמן האלקטרופילי בזמן שהקבוצה העוזבת מתחילה לצאת
- מצב מעבר (Transition State) - הפחמן קשור בחצאי קשרים לנוקלאופיל ולקבוצה העוזבת
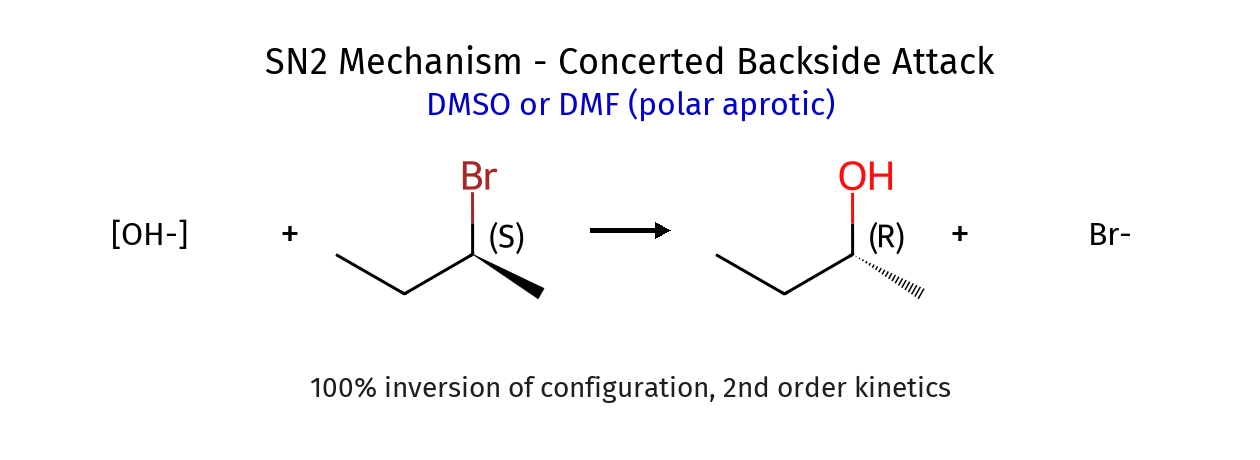
כיוון התקפת הנוקלאופיל
הנוקלאופיל מגיע מהצד ההפוך לקבוצה העוזבת (התקפה אחורית - backside attack):
- הסיבה: דחייה אלקטרוסטטית בין המטענים השליליים
- התוצאה: היפוך קונפיגורציה (inversion of configuration)
אם הפחמן כיראלי (קשור לארבע קבוצות שונות), התוצר יהיה האננטיומר של חומר המוצא.
 |  |
גורמים המשפיעים על תגובת $\mathrm{S_N2}$
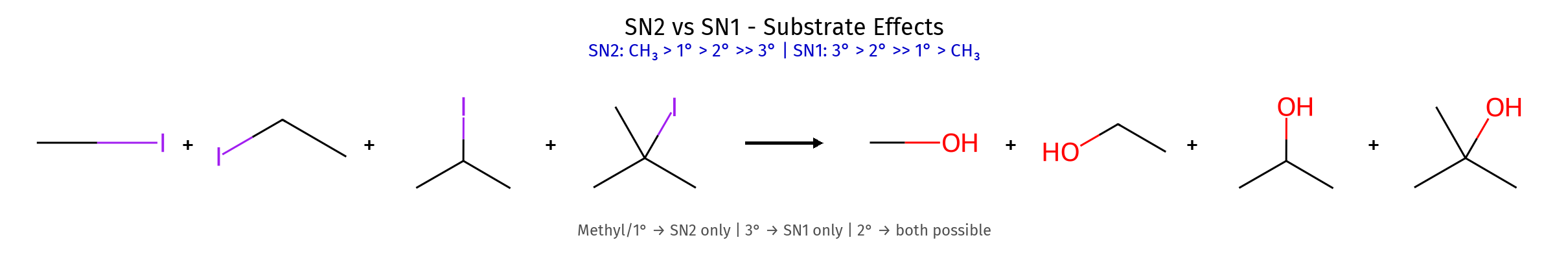
הסובסטרט
מהירות התגובה תלויה במידת ההתמרה של הפחמן האלקטרופילי:
- פחמן מתילי > ראשוני > שניוני > שלישוני
- סיבה: הפרעה סטרית (הפרעה מרחבית)
- תגובת $\mathrm{S_N2}$ כמעט אינה מתרחשת על פחמן שלישוני
הקבוצה העוזבת
קבוצה עוזבת טובה:
- שלילית
- יציבה עם המטען השלילי
- בסיס חלש
בטור ההלוגנים בטבלה המחזורית, ככל שיורדים בטור, הקבוצה העוזבת טובה יותר:
- $\ce{I^-} > \ce{Br^-} > \ce{Cl^-} > \ce{F^-}$
קבוצות עוזבות טובות נוספות:
- מזילט ($\ce{CH3SO3^-}$)
- טוזילט (קבוצת $\ce{-OTs}$)
הנוקלאופיל
נוקלאופיל טוב נקבע לפי:
- בסיסיות:
- בסיס חזק = נוקלאופיל חזק
- בסיס לא יציב עם מטען שלילי
- יתקוף/יתרום אלקטרונים לפחמן האלקטרופילי
- אפקט הגודל (פולריזביליות):
- ככל שהיון גדול יותר, כך הוא נוקלאופיל טוב יותר
- יון גדול יכול “לשלוח” אלקטרונים ממרחק רב יותר
- לא צריך להתקרב מאוד לפחמן האלקטרופילי
- סדר נוקלאופיליות (תלוי קצב תגובה): $\ce{I^-} > \ce{Br^-} > \ce{Cl^-} > \ce{F^-}$
סתירה מעניינת: בעוד ש-$\ce{F^-}$ הוא בסיס חזק יותר מ-$\ce{I^-}$, ה-$\ce{I^-}$ הוא נוקלאופיל טוב יותר בגלל האפקט הקינטי (מהירות התגובה).
סוגי נוקלאופילים
- נוקלאופיל טעון שלילית (כמו $\ce{OH^-}$)
- תוקף עם מטען שלילי
- הופך לניטרלי בתוצר
- נוקלאופיל ניטרלי (תורם זוג אלקטרונים)
- תוקף עם זוג אלקטרונים לא קושר
- מקבל מטען חיובי בתוצר
- נוקלאופיל עם מימנים
- תוקף ויוצר תוצר טעון חיובית
- עובר תהליך משני של חומצה-בסיס (העברת פרוטון)
- בסיס תוקף את הפרוטון ומתקבל תוצר התמרה ניטרלי
סיכום חוזק נוקלאופילים
חוזק הנוקלאופיל נקבע לפי:
- בסיסיות - ככל שהבסיס חזק יותר, כך הנוקלאופיל חזק יותר
- גודל היון (פולריזביליות) - ככל שהיון גדול יותר, כך הנוקלאופיל טוב יותר מבחינה קינטית
חשוב להבין שלעתים יש סתירה בין שני הגורמים הללו, ולכן קיימים מקרים שבהם יון גדול יותר (כמו $\ce{I^-}$ או $\ce{SH^-}$) יהיה נוקלאופיל טוב יותר מיון קטן (כמו $\ce{F^-}$ או $\ce{OH^-}$) למרות שהיון הקטן הוא בסיס חזק יותר.
פולריזביליות והשפעתה על נוקלאופיליות
פולריזביליות משפיעה על חוזק הנוקלאופיל: ככל שמספר האלקטרונים גדול יותר, כך הפולריזביליות גדולה יותר, ומאפשרת יצירת אזורים בעלי מטען שלילי גבוה יותר.
השפעת הממס על תגובות $\mathrm{S_N2}$
בכימיה אורגנית משתמשים בשני סוגי ממסים עיקריים:
- ממסים פולאריים
- ממסים לא פולאריים
בחירת הממס המתאים
הכלל הבסיסי בבחירת ממס הוא “מין במינו” (like dissolves like):
- לחומרים פולאריים בוחרים ממס פולארי
- לחומרים לא פולאריים בוחרים ממס לא פולארי
בתגובות $\mathrm{S_N2}$ יש לנו נוקלאופיל וסובסטרט עם מטענים ($\delta^-$ ו-$\delta^+$), ולכן נדרש ממס פולארי.
סוגי ממסים פולאריים
ממסים פולאריים מתחלקים לשתי קבוצות:
- ממס פולארי פרוטי - בעל קשרי מימן (לדוגמה: מים, מתאנול, אתאנול)
- ממס פולארי אַפרוטי - ללא קשרי מימן (לדוגמה: אצטון, THF)
דוגמה למבנה אצטון:
\[\ce{CH3-C(=O)-CH3}\]ממס מתאים לתגובת $\mathrm{S_N2}$
ממס פולארי אַפרוטי מתאים יותר לתגובת $\mathrm{S_N2}$.
הסיבה: ממס פולארי פרוטי מייצב היטב מטענים, במיוחד מטענים שליליים. הוא יוצר מעטפת ממס (סולבציה) חזקה סביב הנוקלאופיל (שהוא בעל מטען שלילי). כאשר הנוקלאופיל מוקף במעטפת ממס חזקה, הוא פחות פנוי לתקוף את הסובסטרט, מה שמאט את קצב התגובה.
ממס פולארי אפרוטי, לעומת זאת, לא יוצר מעטפת ממס חזקה כל כך סביב הנוקלאופיל, ולכן הנוקלאופיל חופשי יותר לתקוף את הסובסטרט.
תלות חוזק הנוקלאופיל בממס
קיימים שני סוגים של גורמים המשפיעים על חוזק הנוקלאופיל:
- בסיסיות - נוקלאופיל חזק כי הוא בסיס חזק
- גודל היון (פולריזביליות) - נוקלאופיל חזק כי הוא יון גדול
הממס קובע איזה גורם יהיה דומיננטי:
- בממס פולארי פרוטי: (מים, מתנול, חומצה אצטית, אמוניה - כל מה שיש לו אטומי מימן)
- הגודל של היון יקבע את חוזק הנוקלאופיל
- הממס מייצב יותר טוב יונים קטנים מאשר יונים גדולים
- לכן בממס פרוטי, היונים הגדולים יהיו נוקלאופילים טובים יותר
- סדר הנוקלאופיליות:
- בממס פולארי אַפרוטי: (אצטון, THF)
- הבסיסיות תקבע את חוזק הנוקלאופיל
- אין מעטפת משמעותית למטען השלילי של הנוקלאופיל
- הבסיס החזק יהיה הנוקלאופיל החזק יותר
- סדר הנוקלאופיליות:
שאלות על תגובת $\mathrm{S_N2}$
שאלה 1
התגובה הרשומה מטה תהיה הכי מהירה כשהנוקליופיל $\text{Nu:}$ יהיה..?
\[\ce{Nu:^{\ominus} + X-CH2CH2CH3 ->[CH3OH] Nu-CH2CH2CH3 + X^\ominus}\]
- $\ce{Br}$
- $\ce{Cl}$
- $\ce{I}$
- $\ce{F}$
- הקצב אינו תלוי בזהותו של $\ce{Nu}$
התשובה הנכונה היא 3. $\ce{I}$.
ממס מתנול הוא ממס פולארי פרוטי, ולכן הוא מייצב יונים קטנים יותר טוב מאשר יונים גדולים. $\ce{I^-}$ הוא יון גדול ולכן יהיה נוקלאופיל טוב יותר בממס זה.
אם התגובה הייתה במים, התשובה הייתה זהה (גם מים הם ממס פרוטי - אפילו יותר ממתנול).
אם התגובה הייתה ב-DMSO התשובה הייתה שונה, כי במים $\ce{F^-}$ הוא נוקלאופיל טוב יותר. בממס אפרוטי הסדר הפוך לחלוטין - מה שהכי אלקטרושלילי וצפוף גובר על מה שגדול יותר.
בפרוטי:
\[\boxed{\ce{I^-} > \ce{Br^-} > \ce{Cl^-} > \ce{F^-}}\]באפרוטי:
\[\boxed{\ce{F^-} > \ce{Cl^-} > \ce{Br^-} > \ce{I^-}}\]2 - $\mathrm{S_N2}$ בממס THF
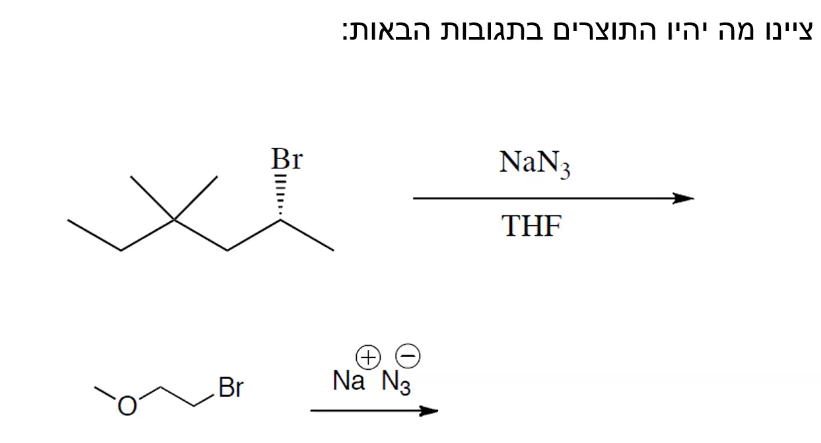
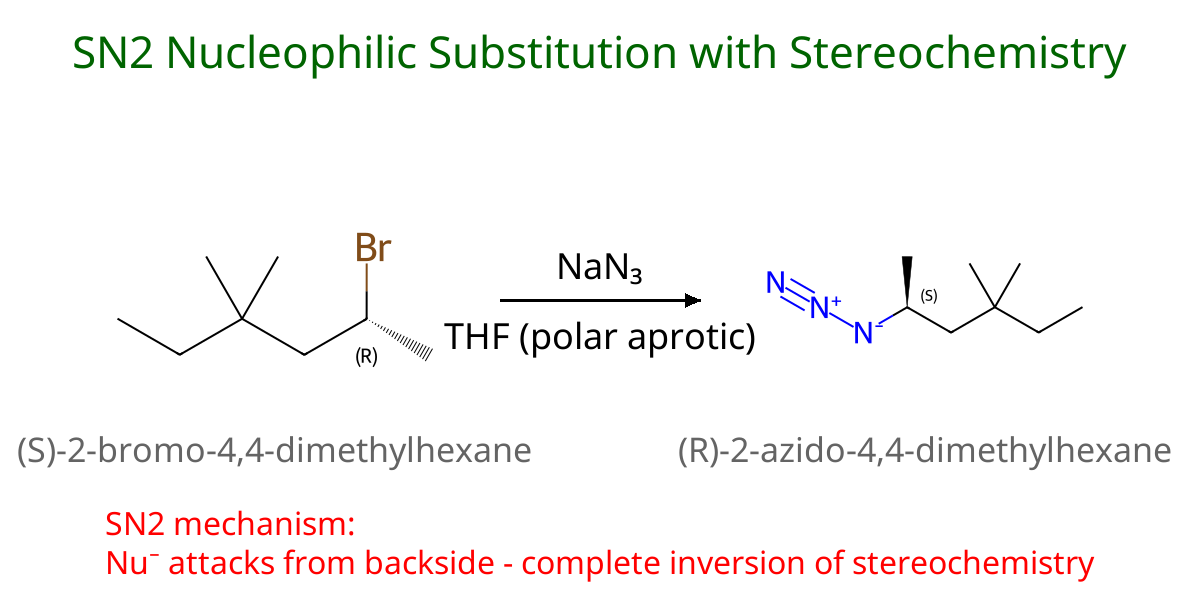
שאלה 3
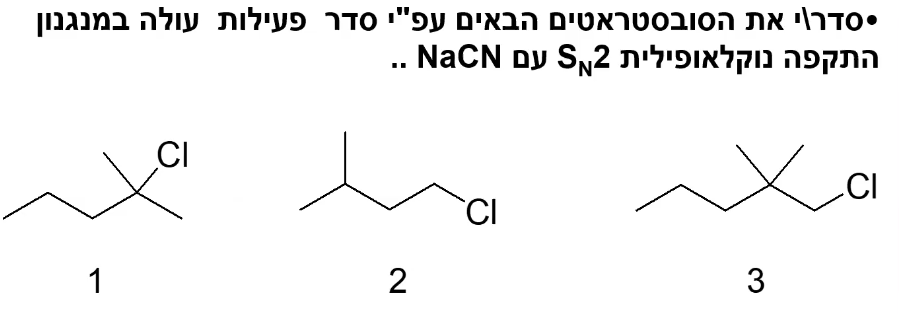
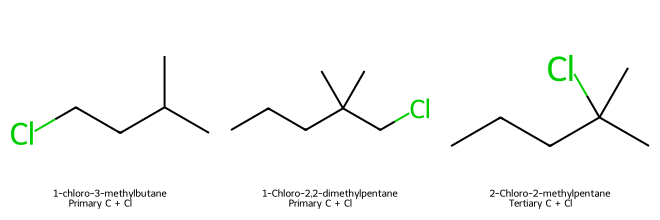
סדר התגובה $\mathrm{S_N2}$ עם $\ce{NaCN}$:
- על פחמן ראשוני
- על פחמן ראשוני עם ..
- על פחמן שניוני
תגובות $\mathrm{S_N1}$
מאפיינים של תגובת $\mathrm{S_N1}$
- קצב התגובה תלוי רק בסובסטרט:
- $\text{Rate} = k \times [\text{Substrate}]$
- לנוקלאופיל אין השפעה על קצב התגובה
- המנגנון מתחלק לשני שלבים:
- שלב ראשון (איטי): פירוק ליונים - הקבוצה העוזבת יוצאת עם זוג אלקטרוני הקשר, נוצרים $\ce{X^-}$ וקרבוקטיון
- שלב שני (מהיר): הנוקלאופיל תוקף את הקרבוקטיון ליצירת תוצר ההתמרה
השלב הראשון (עזיבת הקבוצה העוזבת) הוא השלב שקובע את קצב התגובה - זה שלב איטי וקשה לביצוע מכיוון שמולקולה ניטרלית יציבה צריכה להתפרק ליונים.
פרופיל אנרגיה של תגובת $\mathrm{S_N1}$
בדיאגרמת האנרגיה של תגובת $\mathrm{S_N1}$ ניתן לראות:
- שני שלבים נפרדים
- חומר ביניים (intermediate) - קרבוקטיון ו-$\ce{X^-}$
- אנרגיית אקטיבציה גבוהה לשלב הראשון (השלב האיטי)
- אנרגיית אקטיבציה נמוכה לשלב השני (השלב המהיר)
השוואה בין $\mathrm{S_N1}$ ל-$\mathrm{S_N2}$
- ב-$\mathrm{S_N2}$ הנוקלאופיל תוקף פחמן עם מטען חלקי חיובי ($\delta^+$)
- ב-$\mathrm{S_N1}$ הנוקלאופיל תוקף פחמן עם מטען חיובי מלא (קרבוקטיון)
בגלל זה, גם נוקלאופיל חלש מאוד יכול לתקוף בקלות בתגובת $\mathrm{S_N1}$ - הקרבוקטיון מאוד ריאקטיבי ו”מחפש” אלקטרונים.
הבדלים בסטריאוכימיה
-
ב-$\mathrm{S_N2}$: הנוקלאופיל תוקף מכיוון מאוד ספציפי (מהצד ההפוך לקבוצה העוזבת), לכן מתקבל תוצר בקונפיגורציה הפוכה (היפוך קונפיגורציה)
-
ב-$\mathrm{S_N1}$: חומר הביניים הוא קרבוקטיון בעל מבנה משולש משורי (sp²). הנוקלאופיל יכול לתקוף מכל כיוון - אין הכוונה ספציפית. לכן,* אם הפחמן כיראלי, נקבל תערובת רצמית של שני אננטיומרים*.
גורמים המשפיעים על תגובת $\mathrm{S_N1}$
בניגוד לתגובת $\mathrm{S_N2}$, בתגובת $\mathrm{S_N1}$:
- אין חשיבות לחוזק הנוקלאופיל
- הגורמים החשובים הם הסובסטרט והממס
הממס המועדף לתגובת $\mathrm{S_N1}$ הוא ממס פולארי פרוטי, שמייצב את חומר הביניים הקרבוקטיוני ומאיץ את השלב האיטי של התגובה (כמו מים, מתנול, אתנול).
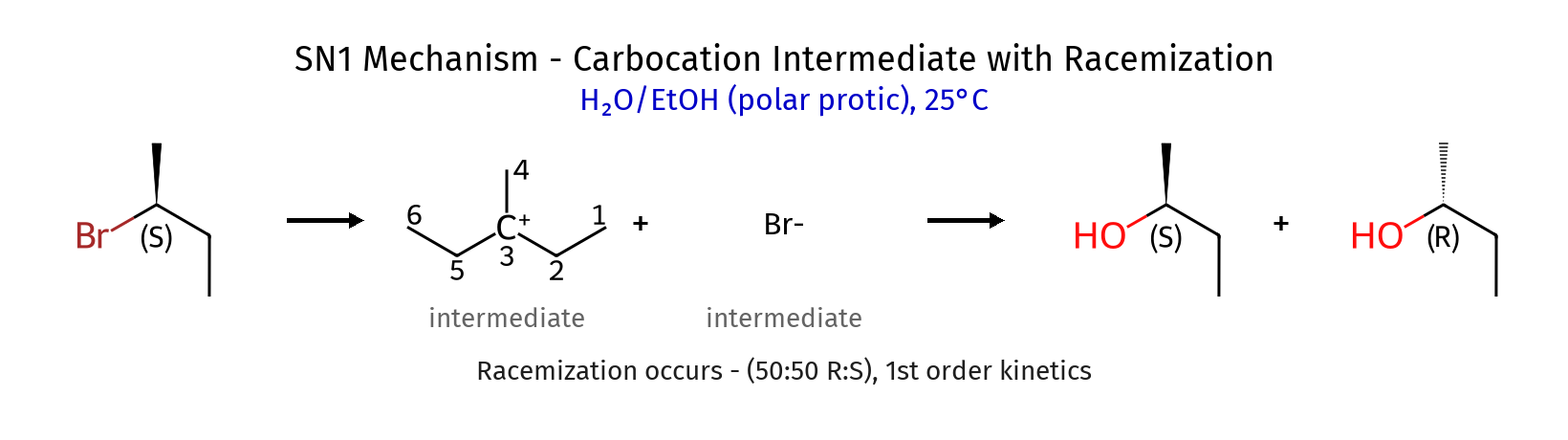
סטריאוכימיה בתגובות $\mathrm{S_N1}$
כאשר הנוקלאופיל (במקרה זה אתנול) תוקף את הקרבוקטיון במנגנון $\mathrm{S_N1}$, הוא יכול לתקוף מכל כיוון. התקיפה יכולה להיות מלמעלה או מלמטה של המישור המשולש-משורי של הקרבוקטיון:
- כאשר הנוקלאופיל תוקף מלמעלה, נקבל קונפיגורציית $S$
- כאשר הנוקלאופיל תוקף מלמטה, נקבל קונפיגורציית $R$
לכן, התוצר של תגובת $\mathrm{S_N1}$ הוא תערובת רצמית (racemic mixture) של שני אננטיומרים ($R$ ו-$S$).
תערובת רצמית היא תערובת של שני אננטיומרים ביחס 50:50, שאינה פעילה אופטית. כלומר, זווית הסיבוב של אור מקוטב היא 0 מעלות, כי כל אננטיומר מסובב את האור בזווית שווה אך בכיוון הפוך.
מושגים בסטריאוכימיה
אננטיומרים
אננטיומרים הם זוג מולקולות שהן תמונות מראה אחת של השנייה, אך אינן חופפות זו את זו. כאשר יש יותר ממרכז כיראלי אחד, מולקולות הן אננטיומרים אם יש היפוך בכל המרכזים הכיראליים. למשל, אם למולקולה אחת יש קונפיגורציה $RR$, האננטיומר שלה יהיה $SS$.
דיאסטריאומרים
דיאסטריאומרים הם איזומרים סטריאויזומריים שאינם תמונות מראה אחד של השני. למשל, אם למולקולה אחת יש קונפיגורציה $RR$, הדיאסטריאומרים שלה יכולים להיות $RS$ או $SR$.
מולקולות מזו (Meso)
מולקולה מזו היא מולקולה שיש בה מרכזים כיראליים, אך היא עצמה אינה כיראלית בגלל מישור סימטריה. ניתן לזהות מולקולת מזו באחת משתי דרכים:
- חיפוש מישור סימטריה במולקולה
- בדיקת הקונפיגורציה של המרכזים הכיראליים:
- אם בפחמן אחד יש קונפיגורציה $R$ ובשני $S$, והקבוצות על שני הפחמנים זהות, המולקולה היא מזו
לדוגמה, במולקולה:
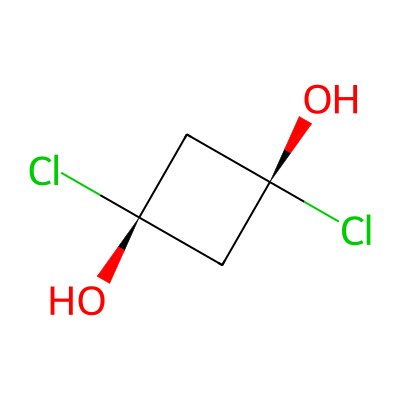
הפחמן העליון הוא $R$ והפחמן התחתון הוא $S$, ולכן המולקולה היא מזו.
שחלופים (Rearrangements - Hydride Shift) בתגובות $\mathrm{S_N1}$
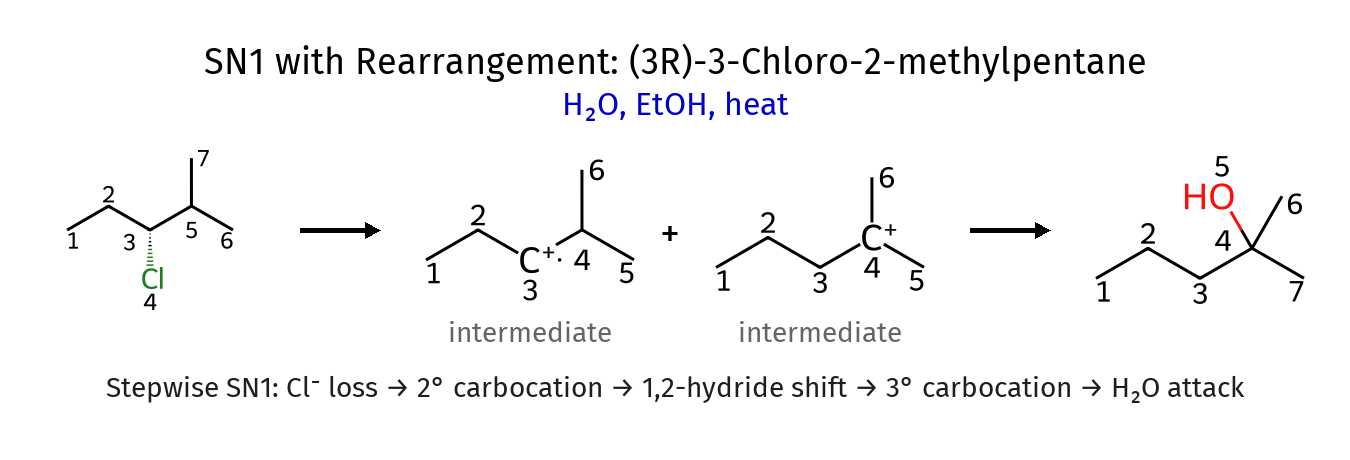
בתגובות $\mathrm{S_N1}$, לאחר יצירת הקרבוקטיון, יכולים להתרחש שחלופים אם הם מייצבים את הקרבוקטיון. לדוגמה, קרבוקטיון שניוני יכול לעבור שחלוף כדי להפוך לקרבוקטיון שלישוני יציב יותר.
שחלוף 1,2-הידריד
תזכורת:
הידריד הוא אטום מימן עם זוג אלקטרונים אחד ($\ce{H^-}$), הוא בסיסי - לעומת מימן פרוטוני למשל.
כאשר יש מימן בעמדה שכנה לקרבוקטיון, המימן יכול לנדוד יחד עם זוג האלקטרונים של הקשר לקרבוקטיון. זהו שחלוף 1,2-הידריד (hydride shift):
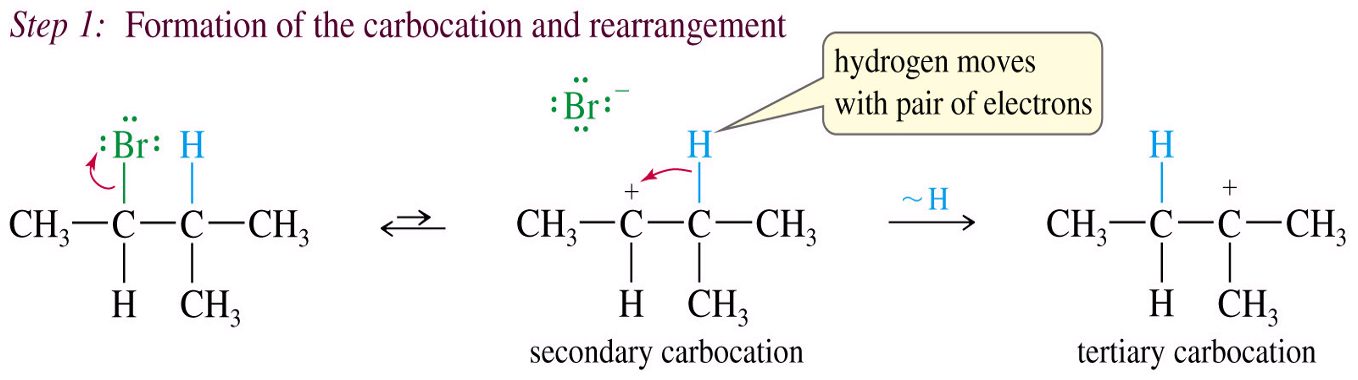
שחלוף 1,2-מתיל
בדומה לשחלוף הידריד, גם קבוצת מתיל (או קבוצת $\mathrm{R}$ אחרת) יכולה לנדוד ממיקומה לקרבוקטיון שכן, כדי ליצור קרבוקטיון יציב יותר.
חשוב לציין: שחלופים מתרחשים רק אם הם משפרים את יציבות הקרבוקטיון (למשל, מעבר משניוני לשלישוני). שחלופים לא יתרחשו בין קרבוקטיונים באותה רמת יציבות (למשל, משניוני לשניוני).
השוואה בין תגובות $\mathrm{S_N1}$ ו-$\mathrm{S_N2}$
| מאפיין | $\mathrm{S_N1}$ | $\mathrm{S_N2}$ |
|---|---|---|
| סובסטרט מועדף | שלישוני > שניוני | מתילי > ראשוני > שניוני |
| חוזק הנוקלאופיל | לא משפיע (חלש מספיק) | חזק (בסיס חזק או יון גדול) |
| קצב התגובה תלוי ב- | סובסטרט בלבד | סובסטרט ונוקלאופיל |
| סטריאוכימיה | תערובת רצמית | היפוך קונפיגורציה |
| ממס מועדף | פולארי פרוטי | פולארי אַפרוטי |
קביעת המנגנון בפחמן שניוני
כאשר הסובסטרט הוא פחמן שניוני, שני המנגנונים יכולים להתרחש. במקרה זה, המנגנון ייקבע לפי הגורמים הנוספים:
- אם הנוקלאופיל חזק (כמו $\mathrm{OH^-}$) ← מנגנון $\mathrm{S_N2}$ (עם היפוך קונפיגורציה)
- אם הנוקלאופיל חלש וממס פולארי פרוטי (כמו מים) ← מנגנון $\mathrm{S_N1}$ (עם תערובת רצמית)
יציבות קרבוקטיונים
קרבוקטיון יציב יותר ככל שהוא יותר מותמר:
- שלישוני > שניוני > ראשוני > מתילי
הסיבות ליציבות הגבוהה של קרבוקטיונים מותמרים:
-
היפר-קוניוגציה - בקרבוקטיון, הקשרים C-H שכנים נמצאים במישור האורביטל הריק (אורביטל p). זוגות האלקטרונים בקשרים אלה יכולים “להשתתף” עם האורביטל הריק, ובכך לייצב את הקרבוקטיון. ככל שיש יותר קשרי C-H שכנים (יותר קבוצות R), כך הקרבוקטיון יציב יותר.
-
רזוננס - אם יש אפשרות לרזוננס (למשל, קרבוקטיון אליל או בנזיל), הקרבוקטיון יהיה יציב יותר.
סדר יציבות קרבוקטיונים
שלישוני עם רזוננס > שלישוני > שניוני עם רזוננס > שניוני > ראשוני עם רזוננס > ראשוני > מתילי
הקבוצה העוזבת
בתגובות התמרה (הן $\mathrm{S_N1}$ והן $\mathrm{S_N2}$), הקבוצה העוזבת צריכה להיות טובה - כלומר, יציבה עם מטען שלילי (בסיס חלש).
סדר הקבוצות העוזבות הטובות (מטובה לפחות טובה):
\[\mathrm{I^-} > \mathrm{Br^-} > \mathrm{Cl^-} > \mathrm{F^-}\]הסדר נקבע לפי גודל היון - ככל שהיון גדול יותר, המטען השלילי מפוזר על נפח גדול יותר, והיון יציב יותר.
קבוצות עוזבות מסילאט וטוזילאט
קבוצת מסילאט (שנכתבת כ-OMs) היא קבוצה עוזבת מצוינת בתגובות כימיות. המבנה שלה מזכיר את המבנה של יודיד מבחינת היכולת לעזוב את המולקולה. מסילאט מורכבת ממבנה שבו קבוצת מתיל (CH₃) מחוברת לחמצן ולאחר מכן לקבוצת סולפון שמכילה שלושה חמצנים. אם נכתוב זאת במילים פשוטות:
\[\ce{CH3-SO3^-}\]קבוצת טוזילאט (שנכתבת כ-OTs) דומה מאוד למסילאט, אך במקום קבוצת מתיל פשוטה, יש לה קבוצת טולואן - טבעת בנזן עם קבוצת מתיל מחוברת אליה. המבנה שלה במילים פשוטות הוא:
\[\ce{C6H4-CH3-SO3^-}\]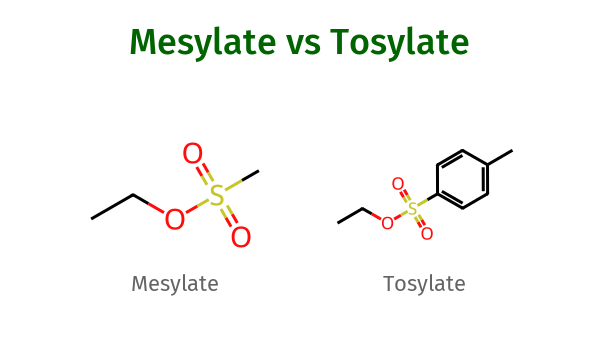
מדוע הן קבוצות עוזבות מצוינות?
שתי הקבוצות האלה נחשבות לקבוצות עוזבות מעולות בגלל שתי סיבות עיקריות:
-
יציבות המטען השלילי: כאשר הן עוזבות את המולקולה, הן לוקחות איתן זוג אלקטרונים ונושאות מטען שלילי. המטען הזה מתפזר על פני מספר אטומי חמצן בקבוצה, מה שמייצב אותן מאוד.
-
רזוננס: המבנה שלהן מאפשר פיזור נוסף של המטען דרך תופעת הרזוננס, כלומר, המטען יכול להתפזר על פני כמה אטומים שונים במולקולה.
כשאתם רואים קבוצות אלה בתגובות, תוכלו להתייחס אליהן כאל קבוצות עוזבות בעלות יכולת דומה ליודיד. למעשה, הן אפילו טובות יותר מיודיד בחלק מהמקרים!
בשאלות במבחן, אם תראו “OMs” או “OTs”, תדעו שמדובר בקבוצות העוזבות המצוינות האלה.
שאלה 4
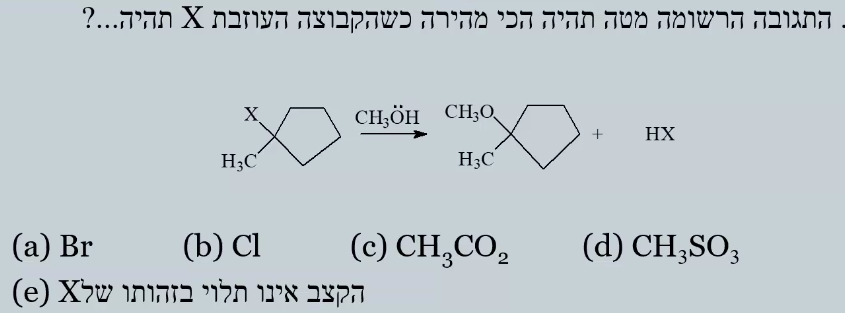
הממס הוא $\ce{CH3OH}$ (מתנול), ושואלים עם איזו קבוצה עוזבת התגובה תתרחש הכי מהר.
מכיוון שהממס הוא פולארי פרוטי, אפשר ומדובר בפחמן שלישוני, התגובה היא במנגנון $\mathrm{S_N1}$.
האפשרויות לקבוצה עוזבת הן:
- $\ce{Br^-}$ - ברומיד
- $\ce{Cl^-}$ - כלוריד
- $\ce{CH3CO2^-}$ - אצטט
- $\ce{CH3SO3^-}$ - מזילט
- לא תלוי בקבוצה עוזבת
תשובה
הקבוצה העוזבת הטובה ביותר היא $\ce{CH3SO3^-}$ (מזילט), מכיוון שהיא יציבה מאוד עם המטען השלילי שלה. היא גם קבוצה עוזבת טובה מאוד בתגובות $\mathrm{S_N1}$.
שאלה 5 - שני תוצרים אפשריים
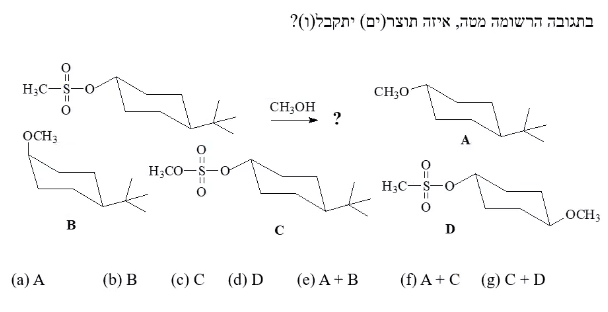
סדר הפתרון:
- סדר הפחמן: שניוני (מחובר גם למימן אקסיאלי שלא כתוב בתרשים)
- חוזק הנוקלאופיל: $\ce{CH3OH}$ (מתנול) הוא נוקלאופיל חלש (נייטרלי - לא מדובר ב$\ce{CH3O^-}$)
- סוג התגובה : $\mathrm{S_N1}$ (מכיוון שהנוקלאופיל חלש, התגובה תתרחש במנגנון $\mathrm{S_N1}$)
-
לבנות לבד את התוצרים - לא להיעזר בתשובות. מה האפשרויות לתוצר?
- התגובה תתרחש עם יצירת קרבוקטיון, ולכן יהיו שני תוצרים אפשריים:
- $\ce{CH3OH}$ תוקף את הקרבוקטיון מעמדה אקווטריאלית (מעל למישור) ← תוצר $\text{R}$
- $\ce{CH3OH}$ תוקף את הקרבוקטיון מעמדה אקסיאלי (מתחת למישור) ← תוצר $\text{S}$
- התגובה תתרחש עם יצירת קרבוקטיון, ולכן יהיו שני תוצרים אפשריים:
התשובה הנכונה היא (e) A + B
שאלה 6 - איזו תגובה מכל צמד תתרחש מהר יותר?
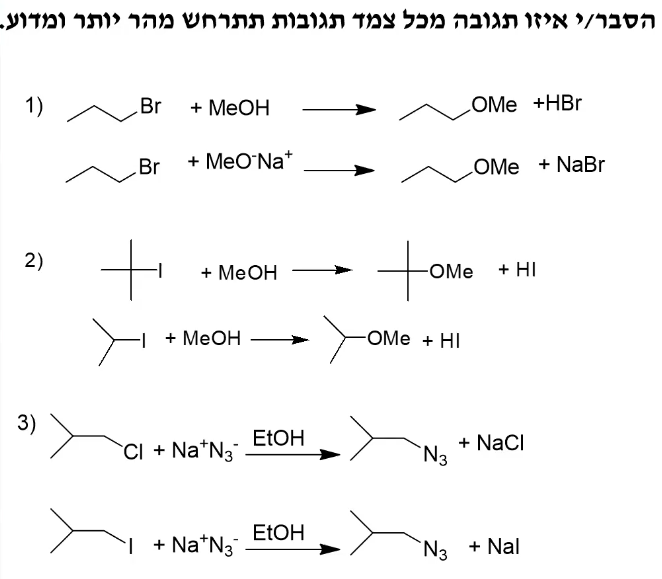
השוואה בין תגובות התמרה ותגובות אלימינציה
תגובות התמרה (SN)
בתגובות התמרה, קורה תהליך של החלפה:
- הנוקלאופיל (חומר עשיר באלקטרונים) מתקרב למולקולה
- הנוקלאופיל מחליף את הקבוצה העוזבת שעל הפחמן האלקטרופילי (הפחמן עם המטען החיובי החלקי)
- הנוקלאופיל “יושב” במקום שבו הייתה קודם לכן הקבוצה העוזבת
תגובות אלימינציה (E)
בתגובות אלימינציה, לעומת זאת, שני חלקים יוצאים מהמולקולה:
- הקבוצה העוזבת יוצאת מהפחמן האלקטרופילי (פחמן $\alpha$)
- מימן יוצא מהפחמן השכן (פחמן $\beta$)
- נוצר קשר כפול בין שני הפחמנים (במקום שני הקשרים הפשוטים שנשברו)
התוצאה של תגובת אלימינציה היא יצירת קשר כפול - תכונה מאוד חשובה מבחינה כימית.
מה קורה בתגובת אלימינציה?
נשברים שני קשרים:
- הקשר בין פחמן $\alpha$ והקבוצה העוזבת
- הקשר בין פחמן $\beta$ והמימן
ונוצר קשר חדש אחד:
- קשר כפול (קשר פאי) בין פחמן $\alpha$ ופחמן $\beta$
מנגנון E2 - יצירת קשר כפול, בסיס חזק, אנטי-סטאגרד
מנגנון E2 הוא מנגנון אלימינציה בימולקולרית שמתרחש בשלב אחד. בדומה ל-$\mathrm{S_N2}$, גם הוא תלוי בשני מגיבים (ולכן “בי-מולקולרי”):
- קצב התגובה = קבוע × [סובסטרט] × [בסיס]
השלבים במנגנון E2
- קטיפת הפרוטון: הבסיס מגיע ו”קוטף” (לוקח) את הפרוטון (מימן) מעמדת $\beta$
- יצירת קשר כפול: בו-זמנית, מתחיל להיווצר קשר כפול בין פחמן $\alpha$ לפחמן $\beta$
- יציאת הקבוצה העוזבת: במקביל, הקבוצה העוזבת מתנתקת מפחמן $\alpha$
חשוב להבין: בשונה מתגובת $\mathrm{S_N2}$, שבה הנוקלאופיל תוקף את הפחמן האלקטרופילי ישירות, ב-E2 הבסיס קוטף פרוטון מהפחמן השכן. זה הבדל מהותי בין התגובות.
כללים לקביעת תוצרי אלימינציה
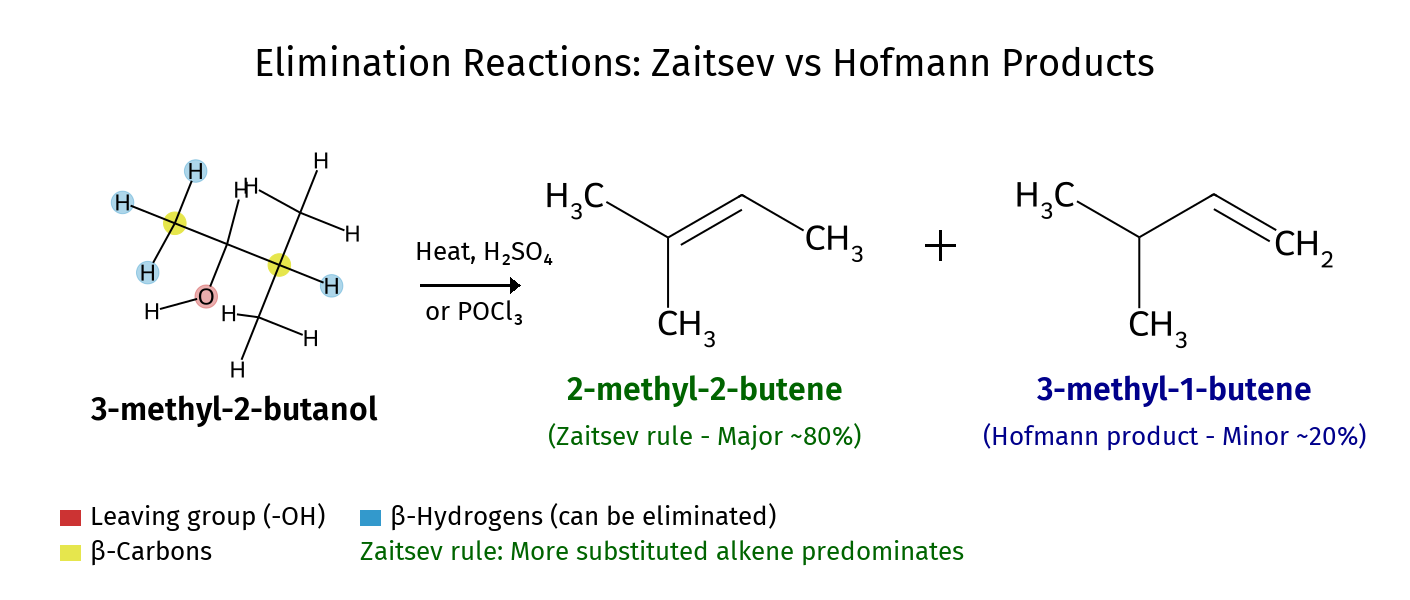
יציבות אלְקֵנים (קשרים כפולים)
- קשר כפול טראנס יותר יציב: כאשר הקבוצות הגדולות נמצאות בצדדים מנוגדים של הקשר הכפול, יש פחות דחייה ביניהן.
- קשר כפול מותמר יותר - יותר יציב: ככל שיותר קבוצות פחמימניות (קבוצות R) מחוברות לפחמנים של הקשר הכפול, כך הקשר יציב יותר.
כלל זייצב
כאשר יש כמה אפשרויות לאלימינציה (כלומר, יש כמה מימני $\beta$ שיכולים להיקטף), התגובה תעדיף את האפשרות שתוביל לקשר הכפול המותמר ביותר.
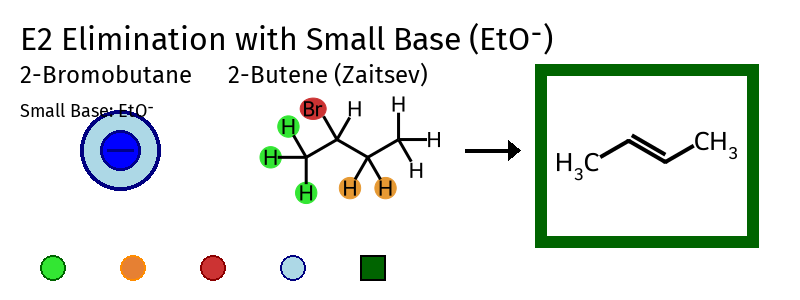
כלל הופמן מתאר מצב מיוחד שבו כלל זייצב לא חל - כאשר הבסיס שקוטף את המימן הוא גדול ונפחי במיוחד. הסיבה: הבסיס הגדול והנפחי מתקשה להגיע למימן שמוקף בהרבה קבוצות גדולות
כלל הופמן
כאשר יש בסיס גדול ונפחי: ייקטף המימן שנמצא בסביבה פחות צפופה (על פחמן פחות מותמר) - כלומר, התגובה תעדיף את האפשרות שתוביל לקשר הכפול הפחות מותמר (הופמן).
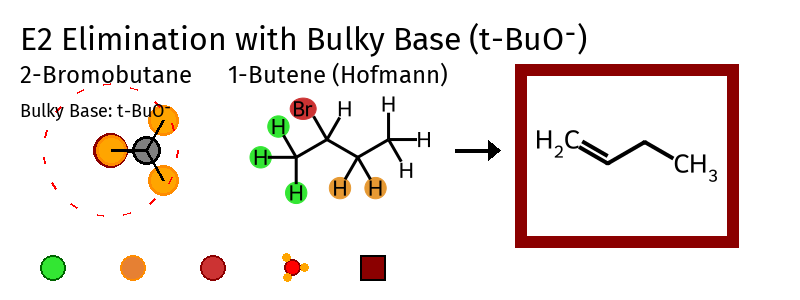
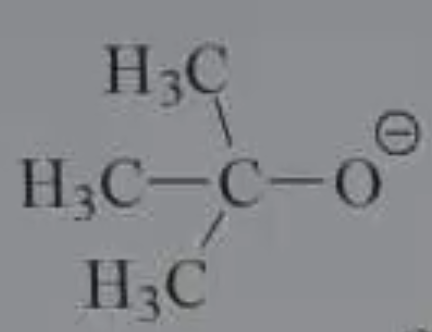
בסיס גדול ונפחי: בסיס שהחמצן שלו שמחובר לפחמן שלישוני (כמו טרט-בוטוקסיד $\ce{(CH3)3CO^-}$ לעיתים כותבים $\ce{t-BuO^-}$ או $\ce{t-BuO-}$).
\[\begin{array}{cccc} & \ce{CH3} & & & \\ & \vert & & & \\ \ce{H3C} & -\ce{C}- & \ce{O^\ominus} & \\ & \vert & & & \\ & \ce{CH3} & & &\\ \end{array}\]
הדרישה הגיאומטרית ב-E2
בתגובת E2, יש דרישה גיאומטרית חשובה מאוד:
- המימן בעמדת $\beta$ והקבוצה העוזבת בעמדת $\alpha$ חייבים להיות באותו מישור ובמצב של אנטי-סטאגרד (מופנים לכיוונים מנוגדים).
למה דווקא אנטי-סטאגרד?
-
יצירת קשר π: הקשר הכפול שנוצר מורכב מקשר σ (סיגמה) וקשר π (פאי). קשר ה-π דורש חפיפה של אורביטלי p בשני הפחמנים, וחפיפה כזו מתאפשרת כאשר המימן והקבוצה העוזבת נמצאים ב”קו ישר” (אנטי-פריפלנרי).
-
מינימום הפרעה: במצב אנטי-סטאגרד, המימן והקבוצה העוזבת רחוקים זה מזה, מה שמפחית את ההפרעה ביניהם במהלך התגובה.
דרישת אנטי-סטאגרד במולקולות ציקליות (טבעתיות)
במולקולות ציקליות כמו ציקלוהקסאן, הדרישה לאנטי-סטאגרד יוצרת אילוץ מיוחד:
- הקבוצה העוזבת והמימן הנקטף חייבים להיות שניהם במצב אקסיאלי (מאונכים למישור הטבעת).
אם הקבוצה העוזבת נמצאת במצב אקוואטוריאלי (במישור הטבעת), האנטי-סטאגרד שלה יהיה אחד מפחמני הטבעת - לא מימן שיכול להיקטף.
לכן, כאשר יש מולקולה ציקלית שבה הקבוצה העוזבת נמצאת במצב אקוואטוריאלי (שזה בדרך כלל המצב היציב יותר), לא תתרחש תגובת E2 אלא אם כן המולקולה תעבור שינוי קונפורמציוני - היפוך כיסא - שיעביר את הקבוצה העוזבת למצב אקסיאלי.
איך קובעים את סוג התגובה?
חשוב לזהות האם תתרחש תגובת התמרה ($\mathrm{S_N1}$, $\mathrm{S_N2}$) או תגובת אלימינציה (E2, E1). כללי אצבע עיקריים:
לפי סוג הפחמן
-
פחמן מתילי: רק $\mathrm{S_N2}$ אפשרי (אין מימני $\beta$ לאלימינציה)
\[\begin{array}{ccccccc} & & & \ce{CH3} & & & \\ & & & \vert & & & \\ & \ce{CH3} & - & \ce{C} & - & \ce{X} & \\ & & & \vert & & & \\ & & & \ce{CH3} & & & \\ \end{array}\] - פחמן ראשוני: בעיקר $\mathrm{S_N2}$, עם אפשרות ל-E2 אם יש סידור אנטי-סטאגרד
- פחמן שניוני: תחרות בין $\mathrm{S_N2}$ ל-E2, כשהבסיס החזק מעודד E2
- פחמן שלישוני: לא מתרחש $\mathrm{S_N2}$ (בגלל הפרעה מרחבית), יש תחרות בין E2 ל-$\mathrm{S_N1}$
לפי סוג הנוקלאופיל/בסיס
- נוקלאופיל חזק ובסיס חזק (כמו $\ce{OH-}$):
- על פחמן ראשוני: בעיקר $\mathrm{S_N2}$
- על פחמן שניוני: בעיקר E2 (תוצר זייצב - יותר מותמר)
- על פחמן שלישוני: רק E2 (תוצר זייצב)
- נוקלאופיל חזק, בסיס חזק, גדול ונפחי (כמו טרט-בוטוקסיד):
- על פחמן ראשוני: בעיקר E2 (תוצר הופמן - פחות מותמר)
- על פחמן שניוני: רק E2 (תוצר הופמן)
- על פחמן שלישוני: רק E2 (תוצר הופמן)
- נוקלאופיל חזק, בסיס חלש (כמו $\ce{Br-}$, $\ce{I-}$):
- על פחמן ראשוני: רק $\mathrm{S_N2}$
- על פחמן שניוני: רק $\mathrm{S_N2}$
- על פחמן שלישוני: $\mathrm{S_N1}$
- נוקלאופיל חלש, בסיס חלש (כמו $\ce{H2O}$):
- על פחמן ראשוני: $\mathrm{S_N2}$ (איטי)
- על פחמן שניוני: בעיקר $\mathrm{S_N1}$, אפשרי שחלוף
- על פחמן שלישוני: רק $\mathrm{S_N1}$, אפשרי שחלוף
שיקולים נוספים בתגובות אלימינציה
כיצד לסובב מולקולה להשגת אנטי-סטאגרד
כאשר רואים מולקולה שהמימן והקבוצה העוזבת אינם באנטי-סטאגרד, יש לסובב סביב הקשר $\ce{C-C}$ כדי להגיע למצב הנדרש:
- חושבים על הסיבוב כעל הזזת כל קבוצה מקום אחד
- אם המימן נמצא בחזית, מסובבים אותו לאחור
- הקבוצה שהייתה מאחור עוברת למישור, והקבוצה שהייתה במישור עוברת לחזית
חשוב לזכור: מספיק סיבוב של 120° סביב הקשר $\ce{C-C}$ כדי להגיע לקונפורמציה חדשה.
קביעת סטריאוכימיה של האַלְקֵן הנוצר
לאחר תגובת E2, הסטריאוכימיה של האלקֵן נקבעת על פי הקונפורמציה המקורית:
- קבוצות שהיו אנטי אחת לשנייה בקונפורמציה המקורית יהיו בצדדים מנוגדים של הקשר הכפול (טראנס)
- קבוצות שהיו גוש אחת לשנייה יהיו באותו צד של הקשר הכפול (ציס)
לדוגמה: אם יש לנו שני פחמנים כיראליים ברצף (RR), ואנחנו מבצעים תגובת E2, הקבוצות שהיו אנטי למימן ולקבוצה העוזבת יהיו טראנס זו לזו בתוצר הסופי.
שאלה 7
\[\text{In a Cyclohexane, leaving Group must be Axial}\]
ציקלוהקסאן עם קבוצת OTs עובר תגובה עם $\ce{KOC(CH3)3}$ ב-$\text{t-BuOH}$ בחימום
פתרון מפורט:
נתונה מולקולת ציקלוהקסאן עם קבוצת טוסילט ($\ce{OTs}$) - קבוצה עוזבת מצוינת.
הבסיס $\ce{KOC(CH3)3}$ (פוטסיום טרט-בוטוקסיד) הוא בסיס חזק ונפחי.
נקודה חשובה מהשיעור: “has no anti-coplanar H”
במולקולה זו, אין מימן בעמדת β שנמצא באנטי לקבוצת $\ce{OTs}$. לכן:
- לא יכולה להתרחש תגובת E2 רגילה
- המולקולה צריכה לעבור היפוך כיסא
אחרי היפוך הכיסא:
- $\ce{OTs}$ עובר לעמדה אקסיאלית
- עכשיו יש H אקסיאלי בעמדת β שהוא אנטי-פריפלנרי
שאלה 8
מולקולת $\text{(R,R) 2-iodo-3-methylpentane}$ עוברת תגובת E2 עם $\ce{NaOCH2CH3}$ באתנול בחימום.
מי מבין הבאים יהיה התוצר הנכון של התגובה?
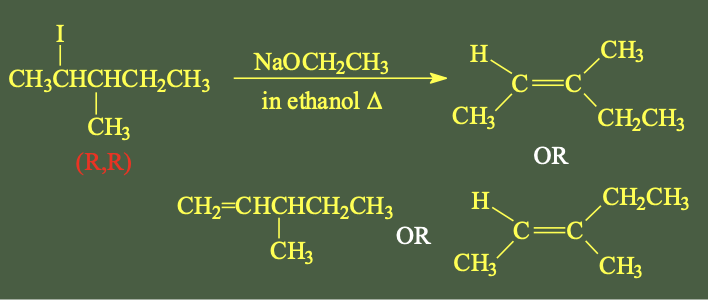
פתרון מפורט:
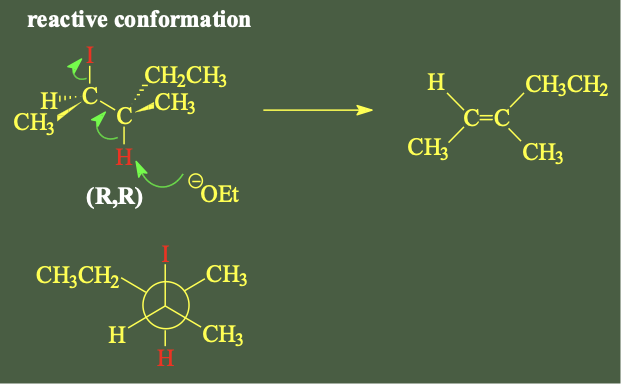
שלב 1: ציור המולקולה בקונפיגורציה RR
מהשם של המולקולה, אנחנו יודעים שיש לה שני פחמנים קירליים, שניהם בקונפיגורציה RR. כמו כן יש סך הכל 5 פחמנים, עם יוד בעמדה 2 וקבוצת מתיל בעמדה 3.
I
|
CH3-CH-CH-CH2-CH3
1 2 |3
CH3
כדי לצייר RR נכון:
- “בעמדה שתיים יש לי יוד, נכון? איך אנחנו נצייר את היוד R?”
- “אני ממקמת אותו פה, אוטומטית, יוצא מהמישור”
- בודקים: 1←2←3 זה יוצא R ✓
שלב 2: זיהוי התגובה
אין בסיס גדול ונפחי (כמו $\ce{(CH3)3CO^-}$), ולכן לא נשתמש בכלל הופמן - התוצר שנקבל בהעדפה יהיה זייצב.”
שלב 3: זיהוי מימני β
I β-H (1)
| ↓
CH3-CH-CH-CH2-CH3
1↑ 2 |3 4 5
| CH3
|
β-H (3) (CH3)
שלב 4: בדיקת קונפורמציה אנטי
הדרישה הנוספת לתגובת E2 היא שהמימן בעמדת β והקבוצה העוזבת (יוד) יהיו אנטי-פריפלנרי.
היוד יוצא מהמישור, ולכן המימן בעמדה 3 (β-H) צריך להיות במישור כדי להיות אנטי-פריפלנרי.
שלב 5: ציור התוצר
אחרי שהמימן נקטף, נשאר $\ce{CH3}$. מי שאנטי ל… הוא … (CH₃), כי הוא נמצא באותו צד של הקשר הכפול. לכן התוצר הוא:
H CH2CH3
\ /
C=C
/ \
CH3 CH3
”$\ce{CH3}$ ו-$\ce{CH3}$ צריכים להיות באותו צד.”
זהו איזומר Z - שתי קבוצות המתיל באותו צד של הקשר הכפול.
שאלה 9
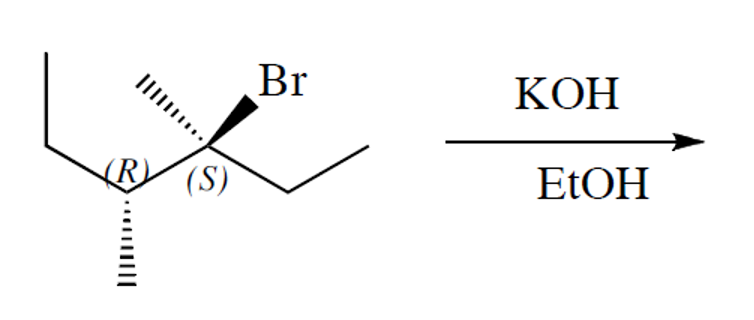
מולקולה עם שני מרכזים כיראליים (R,S) עם קבוצת $\ce{Br}$ עוברת תגובה עם $\ce{KOH}$ ב-$\ce{EtOH}$
מה תוצר התגובה?
נזהה שמדובר בפחמן שלישוני, ולכן התגובה יכולה להיות $\mathrm{S_N1}$ או E2.
מכיוון שהבסיס $\ce{KOH}$ הוא בסיס חזק, התגובה תהיה E2.
הקבוצה העוזבת היא $\ce{Br}$, ולכן נקטף מימן מהפחמן השני (β-H) כדי ליצור קשר כפול מותמר יותר (כלל זייצב).
הקבוצה $\ce{Br}$ יוצאת מהמישור, ולכן המימן שצריך להיקטף הוא זה שנמצא במישור (אנטי-פריפלנרי).
התוצר יהיה קשר כפול בין הפחמן הראשון לפחמן השני, עם קבוצת $\ce{OH}$ על הפחמן הראשון וקבוצת $\ce{CH3}$ על הפחמן השני.
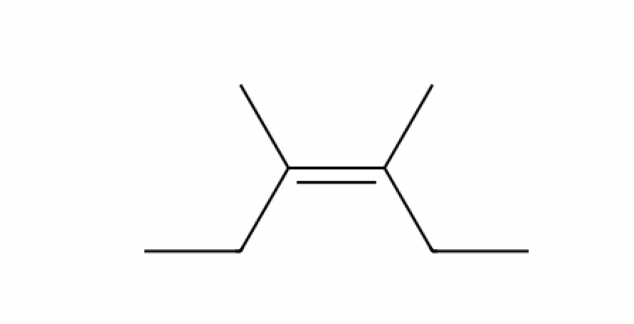
אין אפשרות לתוצר Z, כי המימן והקבוצה העוזבת לא יכולים להיות באותו צד של הקשר הכפול.
דור פסקל