פרק 4: ארכיטקטורה מולקולרית של הגרעין - מבנה הכרומטין ומנגנוני הוויסות האפיגנטי
הקדמה: הגרעין כמרכז בקרה מולקולרי
גרעין התא מייצג את המבנה המורכב ביותר בתא האוקריוטי, המשמש כמרכז הבקרה לכל התהליכים התאיים. מעטפת הגרעין הדו-שכבתית יוצרת תא נפרד המכיל את כל המידע הגנטי הנדרש לתפקוד התא, רבייתו והעברת המידע הגנטי לדורות הבאים. המבנה הייחודי של מעטפת הגרעין, הכוללת קשר רציף בין הממברנה החיצונית לרשת האנדופלזמטית הגסה (rER), מאפשר העברה יעילה של תוצרי שעתוק מהגרעין לאתרי סינתזת החלבונים.
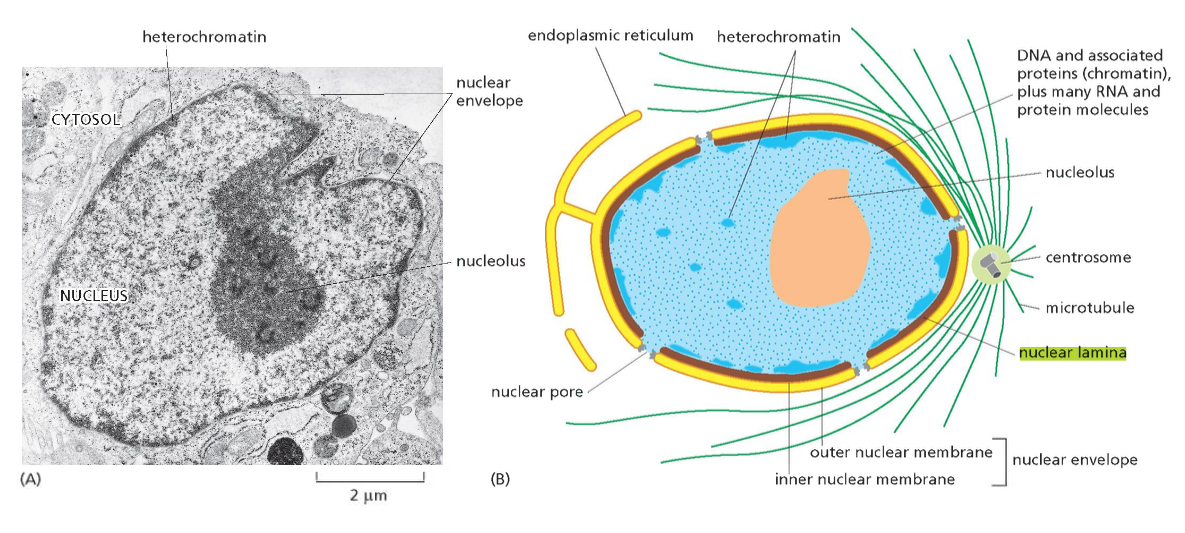
הלמינה הגרעינית: המסגרת המבנית של הגרעין
הממברנה הפנימית של המעטפת הגרעינית קשורה באופן הדוק לרשת חלבונים ייחודית הנקראת הלמינה הגרעינית (Nuclear Lamina). הלמינה הגרעינית מורכבת בעיקר משני חלבונים פיברילריים עיקריים: למין A ולמין B.
למין A ולמין B שייכים למשפחת חלבונים בשם פילמנט ביניים (Intermediate filaments - ״סיבי ביניים״ או ״קורי ביניים״) והם מבצעים מספר תפקידים קריטיים:
תפקידים מבניים:
- שמירה על צורת הגרעין ועל החוזק המכני שלו
- עיגון נקודות חיבור לכרומטין
- ארגון מרחבי של הכרומוזומים בתוך הגרעין
תפקידים רגולטוריים:
- השתתפות בארגון הטרוכרומטין באזור הפריפריה הגרעינית
- וויסות תהליכי חלוקת התא
- השפעה על ביטוי גנים דרך אינטראקציות עם חלבוני שעתוק
המשמעות הרפואית של חלבוני הלמינה
בולטת במספר מחלות קשות הנובעות ממוטציות בגנים המקודדים לחלבונים אלו:
- פרוגריה (תסמונת ההזדקנות המואצת) - מוטציות בגן LMNA גורמות להצטברות חלבון למין A פגום, המוביל לאי-יציבות גרעינית ולהזדקנות מואצת
- מחלות לב תורשתיות - חלק מהקרדיומיופתיות הדילטטיביות נגרמות על ידי מוטציות בלמין A/C
- מחלות נוירודגנרטיביות - קשר בין מוטציות בלמינים לבין צורות מסוימות של מחלת אלצהיימר
ארכיטקטורה של הגנום האנושי: מעבר לפרדיגמה המקודדת
התפלגות התוכן הגנומי
הגנום האנושי, המכיל כ-3.2 מיליארד זוגות נוקלאוטידים הפרוסים על פני 46 כרומוזומים, מציג תמונה מפתיעה של ארגון המידע הגנטי. ניתוח מפורט מגלה כי רק 2.5% מהגנום מקודד לחלבונים, בעוד ש-97.5% הנותרים מורכבים מרכיבים אחרים בעלי משמעות ביולוגית רבה.
החלוקה המפורטת של הגנום האנושי:
- רצפים מקודדים (2.5%)
- אקסונים המתורגמים לחלבונים
- כוללים כ-25,000-20,000 גנים
- אינטרונים (Intron) ואזורים רגולטוריים (47.5%)
- רצפי DNA הנמצאים בין אקסונים
- אלמנטים רגולטוריים (enhancers, silencers, promoters)
- רצפים המקודדים ל-microRNAs ו-long non-coding RNAs
- אלמנטים חוזרים (50%)
- הקטגוריה הגדולה ביותר בגנום
- מתחלקת למספר תת-קטגוריות משמעותיות
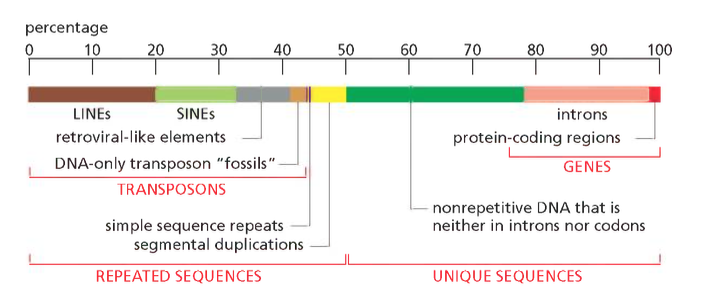
אלמנטים חוזרים: המרכיב הדומיננטי בגנום
״רצפים חוזרים (הידועים גם כאלמנטים חוזרים, יחידות חוזרות או חזרות) הם תבניות קצרות או ארוכות של חומצות גרעין (DNA או RNA) המופיעות במספר עותקים ברחבי הגנום. באורגניזמים רבים, חלק ניכר מה-DNA חוזר על עצמו, כאשר למעלה משני שלישים מהרצף מורכב מאלמנטים חוזרניים בבני אדם.[1] חלק מהרצפים החוזרים הללו נחוצים לשמירה על מבני גנום חשובים כגון טלומרים.
רצפים חוזרים מסווגים לסיווגים שונים לפי תכונות כגון מבנה, אורך, מיקום, מוצא ואופן ההכפלה.״ ויקיפדיה
האלמנטים החוזרים מהווים את הרכיב הגדול ביותר בגנום האנושי ומתחלקים לקטגוריות עיקריות:
אלמנטים חוזרים רטרו-ויראליים (Retroviral Elements)
אלמנטים רטרו-ויראליים נובעים מחדירה של ווירוסים רטרו-ויראליים לגנום האנושי במהלך האבולוציה. התהליך כולל:
- זיהום ראשוני - וירוס רטרו-ויראלי נכנס לתא
- טרנסקריפציה הפוכה - RNA ויראלי מומר ל-DNA באמצעות האנזים Reverse Transcriptase
- אינטגרציה - DNA ויראלי נכנס לגנום המארח
- קיבוע אבולוציוני - אם האינטגרציה מתרחשת בתאי הזרע, הרצף מועבר לצאצאים
התהליך ממשיך להתרחש גם בימינו כאשר אנו נדבקים בווירוסים רטרו-ויראליים:
- HIV/AIDS - משאיר “טביעת אצבע” בגנום התאים הנגועים
- HTLV (Human T-Lymphotropic Virus)
- וירוסי קורונה מסוימים - יכולים להשאיר חתימה גנומית
אלמנטים חוזרים מסוג LINE ו-SINE
LINE (Long Interspersed Nuclear Elements)
- מהווים כ-20% מהגנום
- אורכם נע בין מאות לאלפי נוקלאוטידים
- מקודדים לחלבונים הדרושים לשכפולם העצמי
- הפעילים ביותר הם מסדרת LINE-1 (L1)
SINE (Short Interspersed Nuclear Elements)
- מהווים כ-13% מהגנום
- קצרים יותר מ-LINE (בדרך כלל מתחת ל-500 נוקלאוטידים)
- הנפוצים ביותר הם אלמנטי Alu (כמיליון עותקים בגנום)
- תלויים ב-LINE עבור מנגון השכפול שלהם
Interspersed - “משובץ” או “מפוזר לסירוגין”. כלומר, SINE ו-LINE “משובצים” באקראי בין גנים אחרים או בתוך אזורים לא מקודדים.
הדינמיקה האבולוציונית של אלמנטים חוזרים
אלמנטים חוזרים יכולים לעבור “אבולוציה פנימית” בתוך הגנום באמצעות תהליך רב-שלבי:
- שעתוק - יצירת mRNA מהאלמנט החוזר
- טרנסקריפציה הפוכה - המרת mRNA בחזרה ל-DNA באמצעות Reverse Transcriptase
- אינטגרציה - הכנסת רצף ה-DNA החדש למיקום אחר בגנום
- הרחבת המשפחה - יצירת עותקים רבים של האלמנט
וויסות ביטוי אלמנטים חוזרים
בתאים בריאים, הביטוי של אלמנטים חוזרים נשמר ברמה נמוכה מאוד באמצעות מספר מנגנונים:
- ארגון בהטרוכרומטין - רוב האלמנטים החוזרים נמצאים באזורי כרומטין דחוסים
- מתילציה של DNA - מעכבת שעתוק של רצפים חוזרים
- מודיפיקציות מעכבות של היסטונים - יוצרות סביבה כרומטינית שלא מתאימה לשעתוק
השלכות פתולוגיות של אי-וויסות
כאשר מערכות הוויסות נכשלות, כמו במחלות הבאות, אלמנטים חוזרים עלולים להתבטא בצורה לא מבוקרת:
- סרטן - אי-יציבות גנומית גורמת לביטוי אלמנטים חוזרים
- פרוגריה - הזדקנות מואצת קשורה לשבירה של ארגון הכרומטין
- מחלות אוטואימוניות - ביטוי אלמנטים חוזרים עלול לעורר תגובה חיסונית
מבנה ודינמיקה של הכרומטין
האתגר הפיזיקלי של אריזת DNA
הגנום האנושי מכיל בכל תא סומטי (תא בגוף שאינו תא מין - כלומר לא תא זרע או ביצית), 46 כרומוזומים (23 זוגות), ואם נפרוש את כל מולקולות ה-DNA במשטח ליניארי, נקבל אורך כולל של כ-שני מטר. התא צריך לארוז כמות עצומה זו של מידע גנטי בתוך גרעין שקוטרו נע בין 20-5 מיקרומטר בלבד - יחס דחיסה של יותר ממיליון לאחד.
למה DNA לא יכול להתקיים לבד?
מולקולת DNA גולמית בתוך התא הייתה:
- נפגעת מיד על ידי מנגנוני ההגנה התאיים שמזהים DNA חופשי כאיום
- חשופה לנזק מרדיקלים חופשיים ומחמצנים סלולריים
- לא זמינה בצורה מבוקרת לתהליכי שעתוק ושכפול
- עלולה ליצור קשרים לא רצויים עם מולקולות אחרות
לכן, כל ה-DNA בתא האוקריוטי קיים בצורה של כרומטין - קומפלקס דינמי של DNA וחלבונים המספק הגנה, ארגון וויסות.
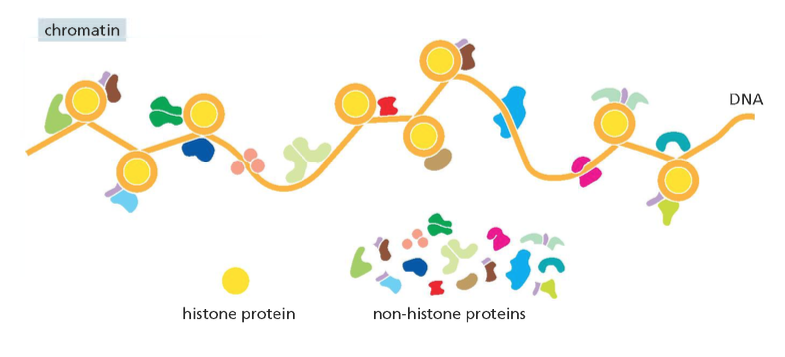
הנוקלאוזום: היחידה הבסיסית של הכרומטין
הרכב מולקולרי של הנוקלאוזום
הנוקלאוזום מהווה את אבן הבניין הבסיסית של הכרומטין.
הנוקלאוזום מורכב ממרכיבים מדויקים:
רכיב ה-DNA
- 147 זוגות נוקלאוטידים בדיוק
- DNA דו-גדילי נכרך סביב ליבת ההיסטון פעם אחת ושלושה רבעים
- כל “לפיפה” של ה-DNA סביב ההיסטון כוללת כ-10.4 זוגות נוקלאוטידים
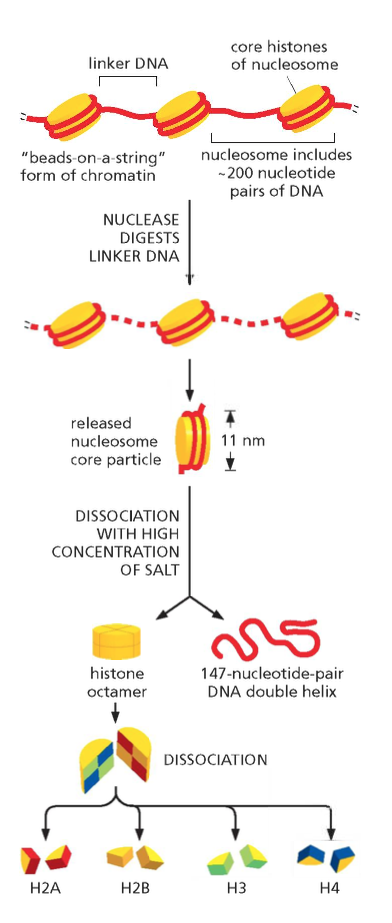
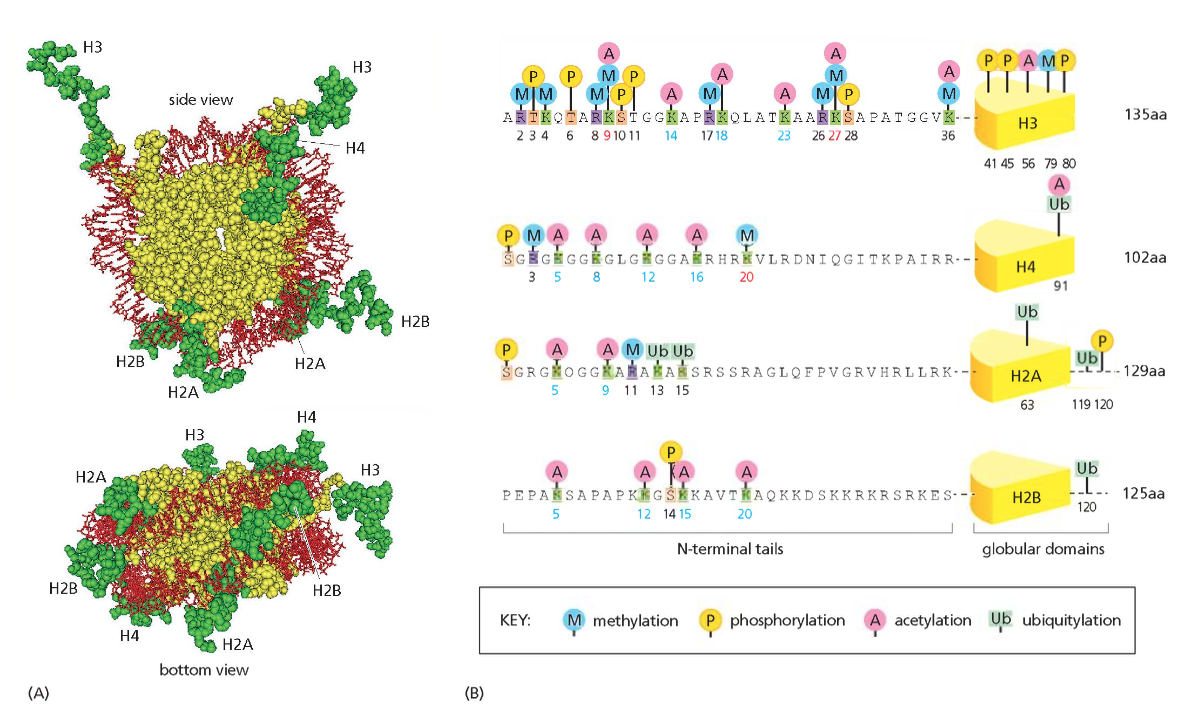
ליבת ההיסטון (Histone Octamer)
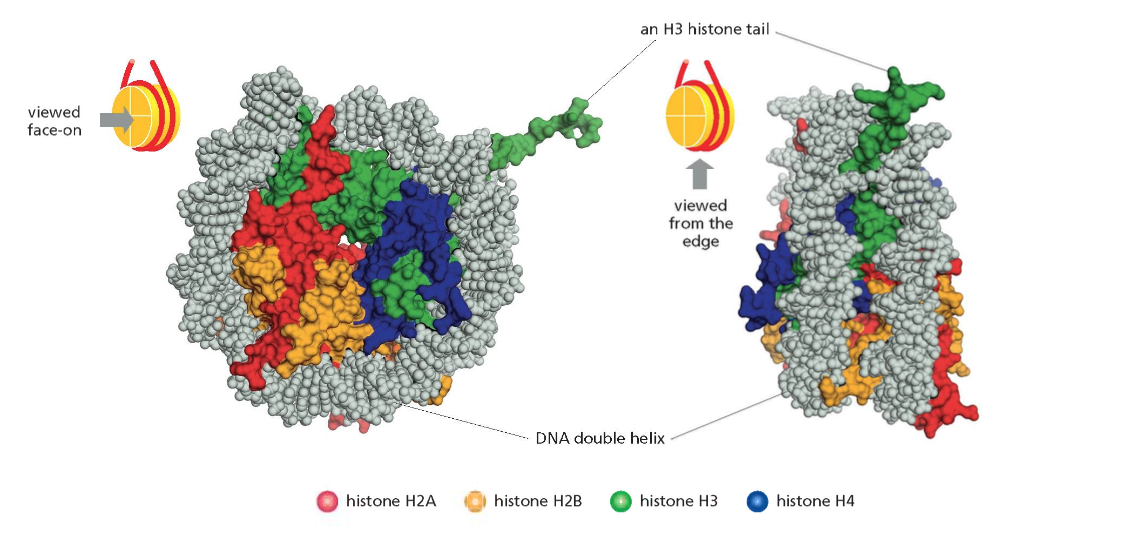
שמונה חלבוני היסטון המורכבים מארבעה זוגות:
- שני עותקים של H2A
- שני עותקים של H2B
- שני עותקים של H3
- שני עותקים של H4
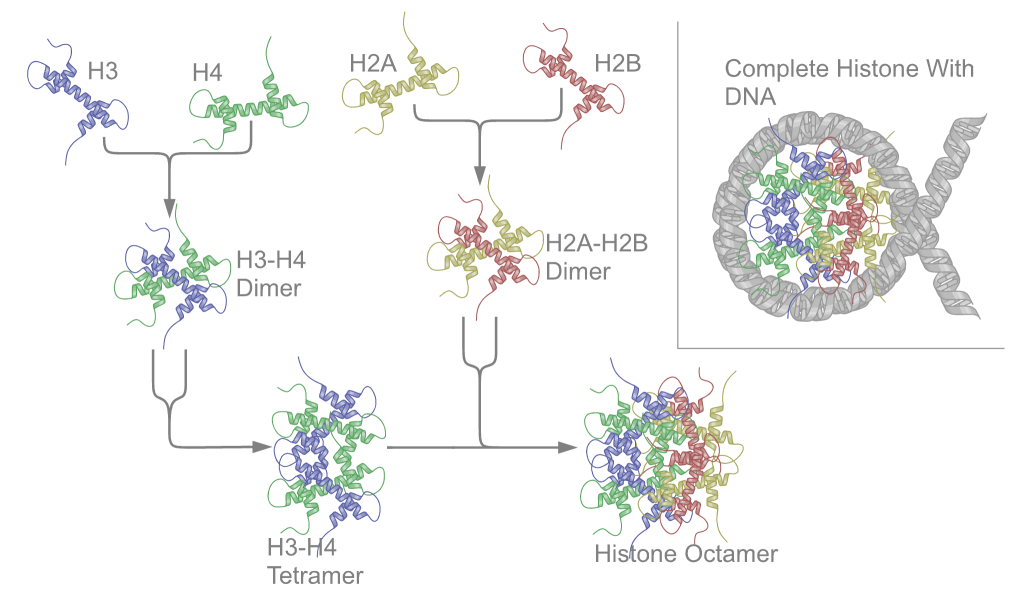
חלבונים אלו מאורגנים כדימרים יציבים:
- דימר H2A-H2B (מתקשר כיחידה)
- דימר H3-H4 (מתקשר כיחידה)
- שני דימרים H3-H4 יוצרים טטרמר מרכזי
- שני דימרי H2A-H2B נקשרים לטטרמר המרכזי
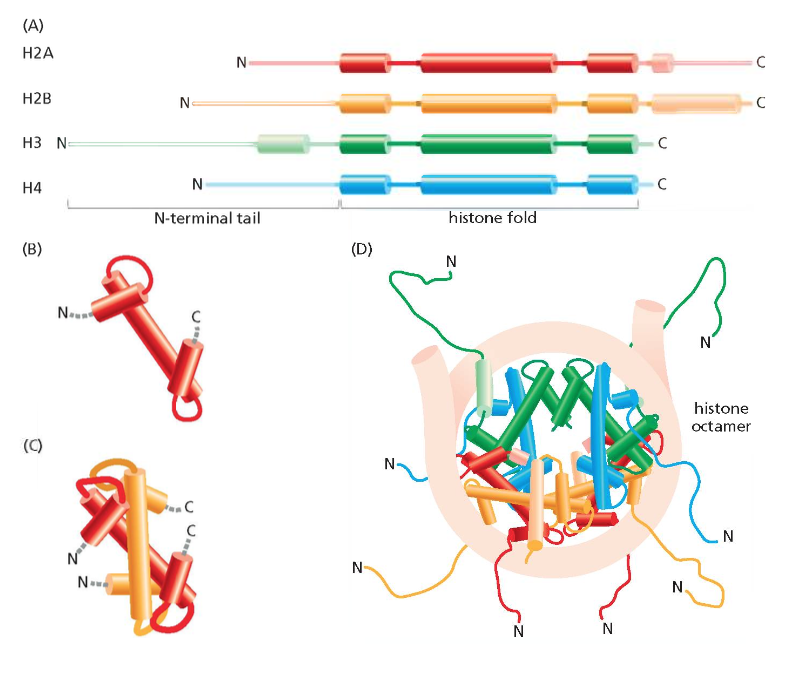
מאפיינים מולקולריים של אינטראקציות DNA-היסטון
טבע הקשרים
הקישור בין DNA לחלבוני ההיסטון הוא לא קוולנטי. הוא מבוסס על מספר סוגי אינטראקציות:
- קשרי מימן - בין זוגות הבסיסים לחומצות האמינו בחלבוני ההיסטון
- אינטראקציות אלקטרוסטטיות - בין הזרחתנים הטעונים שלילית ב-DNA לחומצות ליזין וארגינין הטעונות חיוביתיות בהיסטונים
- כוחות ואן דר ואלס - אינטראקציות חלשות המתרחשות במרחקים קצרים
מיקום הקישור - התעלה הקטנה
הקשר בין DNA לחלבוני ההיסטון מתרחש בעיקר דרך ה-Minor Groove (תעלה קטנה או אולי חריץ קטן) של מולקולת ה-DNA. באזור זה ניתן לגשת לזוגות הבסיסים מבלי לפתוח את הסליל הכפול, מה שמאפשר זיהוי ספציפי של רצפים.
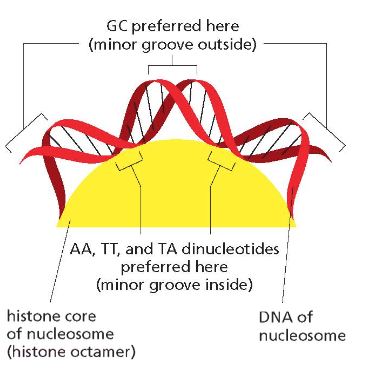
ספציפיות רצף
יש עדיפות ברורה לרצפי נוקלאוטידים מסוימים:
- AA (אדנין-אדנין)
- TT (תימין-תימין)
- TA (תימין-אדנין)
הרצפים האלו יוצרים בתעלה הקטנה מבנה תלת-ממדי שמתאים במיוחד לקישור חלבוני היסטון. זה מסביר מדוע:
- אלמנטים חוזרים, העשירים ברצפים אלו, נקשרים בחוזקה לנוקלאוזומים
- אזורים אלו נמצאים לרוב בהטרוכרומטין דחוס
- השחרור של אזורים אלו מנוקלאוזומים דורש השקעת אנרגיה רבה
רמות הארגון הכרומטיני
הכרומטין מאורגן בהיררכיה של רמות דחיסה, החל מהמבנה הבסיסי ועד לכרומוזום המיטוטי הדחוס לחלוטין.
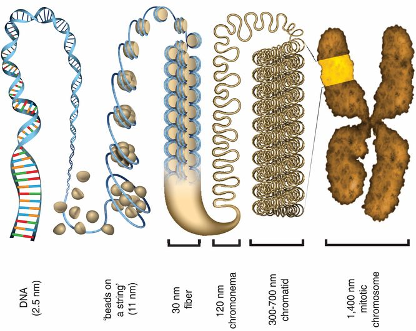
רמה ראשונה: “חרוזים על חוט” (11 ננומטר)

המבנה הבסיסי, הנקרא “Beads on a String”, מורכב מ:
- נוקלאוזומים (ה”חרוזים”) בקוטר של כ-11 ננומטר
- רצפי DNA מקשרים (Linker DNA) באורך של 80-20 נוקלאוטידים
- מבנה זה נראה במיקרוסקופ אלקטרונים כשרשרת חרוזים
רמה שנייה: סיבי 30 ננומטר
במצבים מסוימים, הנוקלאוזומים יכולים להידחס ליצירת מבנה עבה יותר:
- קוטר של כ-30 ננומטר
- דורש נוכחות יונים (במיוחד $\ce{Mg^{2+}}$) כדי לשמור על יציבות
- תלוי במודיפיקציות של זנבות ההיסטון
- מציג רמת דחיסה של כ-6 פעמים ביחס לרמה הבסיסית
רמה שלישית: כרומטין בינוני (300 ננומטר)
רמת דחיסה ביניים הכוללת:
- לולאות כרומטין המעוגנות לחלבוני scaffold
- דחיסה של כ-50-40 פעמים
- נמצאת באזורים מסוימים גם באינטרפאזה
רמה רביעית: הכרומוזום המיטוטי (1400 ננומטר)
הרמה הדחוסה ביותר, המתרחשת רק במיטוזה (חלוקת התא):
- קוטר של כ-1.4 מיקרומטר
- דחיסה של כ-10,000 פעמים ביחס ל-DNA גולמי
- מאפשרת ראייה במיקרוסקופ אור רגיל
- חיונית לחלוקה תקינה של הכרומוזומים
מנגנוני הוויסות הכרומטיני
הכרומטין (ה-DNA והחלבונים הקשורים אליו) הוא מבנה דינמי המשתנה כל הזמן בהתאם לצרכי התא. קיימים ארבעה מנגנונים עיקריים המאפשרים שליטה מדויקת במבנה הכרומטין:
מודיפיקציות של זנבות ההיסטון
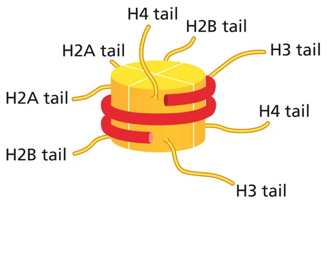
מבנה זנבות ההיסטון
זנבות חלבוני ההיסטון הן הקצוות ה-N-טרמינליים הבולטים מחוץ לליבת הנוקלאוזום. זנבות אלו:
- עשירים בחומצות אמינו בסיסיות (ליזין וארגינין)
- גמישים ונגישים לאנזימי מודיפיקציה
- לא מובנים (unstructured) במצבם הטבעי
- מהווים פלטפורמה לקישור חלבונים רגולטוריים
סוגי המודיפיקציות העיקריות
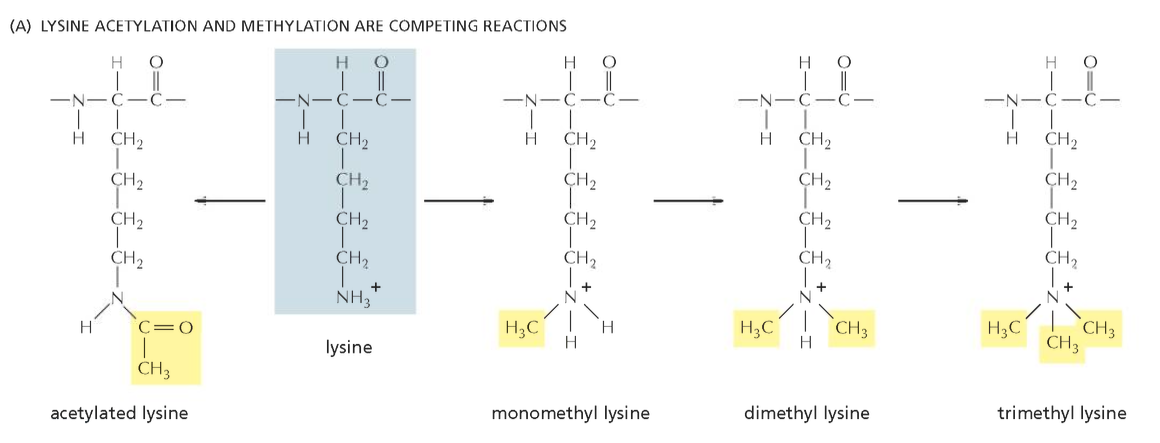
מתילציה (Methylation):
- מתרחשת בעיקר על ליזין וארגינין
- יכולה לכלול 1, 2 או 3 קבוצות מתיל (mono-, di-, tri-methylation)
- דוגמאות לסגירת כרומטין:
- H3K9me3 (tri-methylation של ליזין 9 בהיסטון H3)
- H3K27me3 (tri-methylation של ליזין 27 בהיסטון H3)
- דוגמאות לפתיחת כרומטין:
- H3K4me3 (tri-methylation של ליזין 4 בהיסטון H3)
- H3K36me3 (tri-methylation של ליזין 36 בהיסטון H3)
אצטילציה (Acetylation):
- מתרחשת כמעט תמיד על ליזין
- בדרך כלל מקושרת לפתיחת כרומטין ולביטוי גנים
- מנטרלת את המטען החיובי של הליזין, מחלישה את הקישור ל-DNA
- דוגמאות:
- H3K27ac (acetylation של ליזין 27 בהיסטון H3)
- H4K16ac (acetylation של ליזין 16 בהיסטון H4)
אוביקוויטינציה (Ubiquitination):
- הוספת חלבון אוביקוויטין קטן (76 חומצות אמינו)
- יכולה לסמן חלבונים לפירוק או לשינוי תפקוד
- H2AK119ub1 - סימון לחלבונים מדכאי שעתוק
פוספורילציה (Phosphorylation):
- מתרחשת בעיקר על סרין ותראונין
- חשובה במיוחד במהלך חלוקת התא
- H3S10ph - מסמן התחלת קונדנסציה כרומטינית במיטוזה
הקונטקסט קובע את המשמעות
עקרון מהותי בביולוגיה האפיגנטית הוא שמשמעות המודיפיקציה תלויה בהקשר:
- אותה מודיפיקציה יכולה לגרום לפתיחה או לסגירה בהתאם למיקום הגנומי
- שילוב מודיפיקציות יוצר “קוד היסטון” מורכב
- חלבונים “קוראים” מזהים מודיפיקציות ומפעילים תגובות תאיות
החלקת נוקלאוזומים (Nucleosome Remodeling)
משפחת חלבוני SWI/SNF
מחליקי הנוקלאוזומים הם קומפלקסים חלבוניים גדולים השייכים למשפחת SWI/SNF (Switch/Sucrose Non-Fermentable). משפחה זו כוללת מספר תת-משפחות:
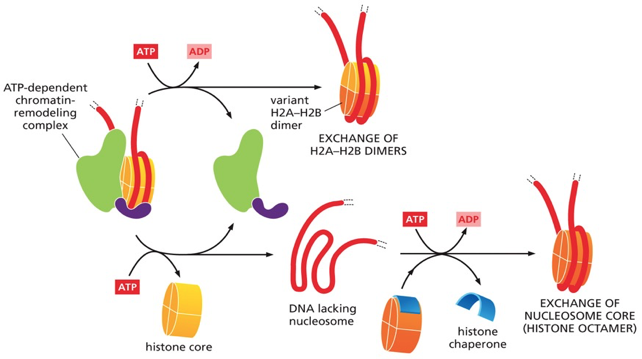
מנגנון הפעולה של SWI/SNF
- זיהוי המטרה - הקומפלקס נקשר לרצפי DNA ספציפיים או לכרומטין המכיל מודיפיקציות מסוימות
- הידרוליזת ATP - השימוש באנרגיה מ-ATP מאפשר שינוי קונפורמציה של הקומפלקס
- העברת כוח מכני - הקומפלקס “מסובב” את ה-DNA יחסית לליבת ההיסטון
- הזזה הדרגתית - כל מולקולת ATP מאפשרת החלקה של נוקלאוטיד אחד
צריכת האנרגיה:
- נוקלאוזום מלא מכיל 147 זוגות נוקלאוטידים
- שחרור מלא דורש 147 מולקולות ATP
- זהו תהליך יקר מאוד מבחינה אנרגטית, המתרחש רק כאשר יש צורך דחוף בנגישות ל-DNA
תת-משפחות עיקריות:
- SWI/SNF - מתמחה בפתיחת כרומטין לשעתוק
- ISWI - מתמחה בארגון מחדש של מבנה הכרומטין
- CHD - משתתף גם בפתיחה וגם בדחיסה של כרומטין
השמטה והחלפה של נוקלאוזומים
מנגנון השמטת נוקלאוזומים:
תהליך זה כולל הסרה זמנית או קבועה של חלבוני ההיסטון מה-DNA, ויכול להתרחש בשני מצבים:
השמטה חלקית - הסרת דימרים:
- הסרת דימר H2A/H2B תוך השארת הטטרמר H3/H4
- מאפשרת נגישות חלקית ל-DNA
- תהליך יחסית מהיר וקל להחזרה
השמטה מלאה - הסרת כל הליבה:
- הסרת כל שמונה חלבוני ההיסטון
- שחרור מלא של 147 זוגות הנוקלאוטידים
- נדרשת לתהליכים הדורשים נגישות מלאה כמו שכפול DNA
מנגנון החלפת וריאנטים:
במקום השמטה מלאה, לעיתים מתרחשת החלפה של חלבוני היסטון בוריאנטים בעלי תכונות שונות:
וריאנטים של H2A:
- H2A.Z - מקל על שעתוק ופתיחת כרומטין
- H2A.X - חיוני לתיקון נזקי DNA, במיוחד שברים כפולים
- macroH2A - מעורב בהשתקת כרומוזום X
וריאנטים של H3:
- H3.3 - מופק בכל שלבי מחזור התא, לא רק ב-S phase
- CENP-A - מחליף את H3 באזור הצנטרומר
מתי מתרחשת החלפה:
- במהלך שעתוק פעיל - החלפה ב-H2A.Z ו-H3.3
- לאחר נזק ל-DNA - החלפה ב-H2A.X
- במהלך התמיינות - החלפות ספציפיות לרקמה
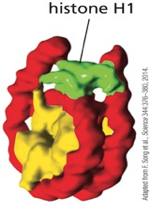
חלבון הלינקר היסטון H1
מבנה ותפקוד של היסטון H1
היסטון H1 הוא חלבון נוסף שלא נמצא בליבת הנוקלאוזום אלא נקשר בין נוקלאוזומים. מאפייניו:
מיקום הקישור של H1
- נקשר ל-Linker DNA (ה-DNA המקשר בין נוקלאוזומים)
- יוצר אינטראקציות עם זנבות ההיסטון שעברו מודיפיקציות מתאימות
- “מהדק” את הנוקלאוזומים זה לזה
השפעת H1 על מבנה הכרומטין
- נוכחות H1 - יוצרת מבנה דחוס ויציב של הטרוכרומטין
- העדר H1 - מאפשרת מבנה פתוח יותר של אוכרומטין
- רמות משתנות - כמות H1 קובעת את רמת הדחיסה
וריאנטים של H1
קיימים מספר וריאנטים של H1 עם ביטוי ספציפי לרקמה ולשלב התפתחותי:
- H1.0 - נמצא ברוב הרקמות הבוגרות
- H1.1-H1.5 - ביטוי ספציפי לסוג תא
- H1t - ספציפי לתאי יצירת הזרע
- H1oo - ביצית וטמיחה ראשונית
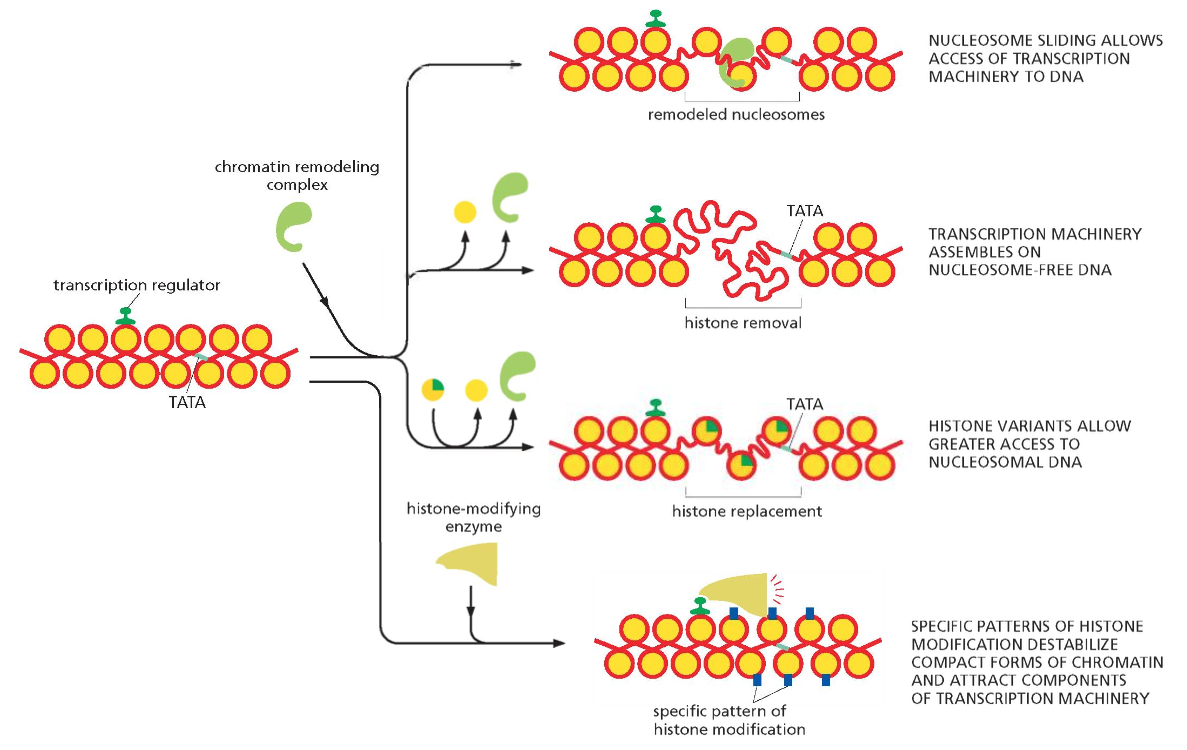
סיווג והתפלגות מצבי הכרומטין
אוכרומטין לעומת הטרוכרומטין
הכרומטין בגרעין התא מתחלק לשני מצבים עיקריים המבוססים על רמת הדחיסה והפעילות הטרנסקריפציונית:
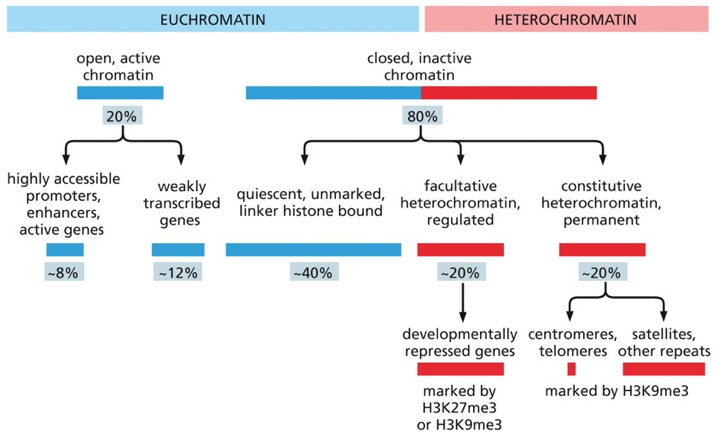
אוכרומטין (Euchromatin) - כרומטין פעיל:
- מהווה כ-20% מכלל הכרומטין בתא ממוצע
- מאופיין במרחקים גדולים יחסית בין נוקלאוזומים
- נגיש לחלבוני שעתוק ורגולציה
- עשיר במודיפיקציות “פתוחות” כמו H3K4me3, H3K27ac
- נמצא בדרך כלל במרכז הגרעין
- מכיל גנים הנמצאים בביטוי פעיל או פוטנציאלי
הטרוכרומטין (Heterochromatin) - כרומטין דחוס:
- מהווה כ-80% מכלל הכרומטין
- מאופיין בנוקלאוזומים דחוסים עם מרחקים קטנים
- לא נגיש לחלבוני שעתוק ברוב המקרים
- עשיר במודיפיקציות “סוגרות” כמו H3K9me3, H3K27me3
- נמצא בעיקר בפריפריה הגרעינית, סמוך למעטפת הגרעין
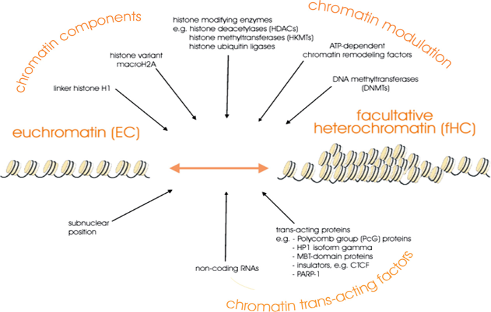
תת-סוגי הטרוכרומטין
ההטרוכרומטין מתחלק לשני תת-סוגים עיקריים על בסיס יכולת הפתיחה:
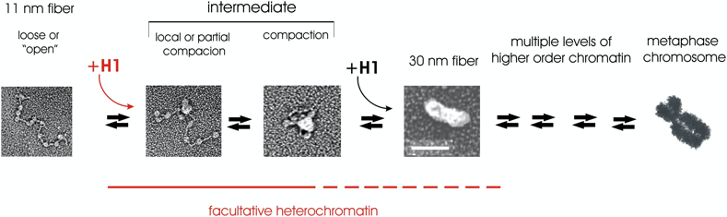
הטרוכרומטין פקולטטיבי (Facultative Heterochromatin):
- המונח “פקולטטיבי” נגזר מ”פקולטה” = הזדמנות/אפשרות
- כרומטין שסגור זמנית אך יכול להיפתח בתגובה לאותות תאיים
- מאופיין בקודים אפיגנטיים הפיכים
- אינו מכיל היסטון H1 ברמות גבוהות
- דוגמאות:
- גנים רגולטוריים התפתחותיים שפועלים בשלבים מסוימים
- אזורים הנפתחים בתגובה לגירויים סביבתיים
- חלק מכרומוזום X בנקבות (X-inactivation)
הטרוכרומטין קונסטיטוטיבי (Constitutive Heterochromatin):
- נשאר דחוס באופן קבוע ולא נפתח במצבים פיזיולוגיים רגילים
- מאופיין בנוכחות יציבה של היסטון H1
- עשיר במודיפיקציות יציבות כמו H3K9me3
- מיקומים עיקריים:
- צנטרומרים - אזורי הקישור של הכרומטידים
- טלומרים - קצוות הכרומוזומים
- אזורי רצפים חוזרים - LINE, SINE, ואלמנטים רטרו-ויראליים
חשיבות ביולוגית של הטרוכרומטין קונסטיטוטיבי
שמירה על המצב הסגור של אזורים אלו חיונית מכמה סיבות:
- מניעת אי-יציבות גנומית - אלמנטים חוזרים עלולים לגרום לרקומבינציה לא הומולוגית
- הגנה מפני מוטגנזה - אזורים אלו עלולים להזיק לגנים חיוניים
- שמירה על שלמות הכרומוזום - מניעת פיוז’ן של קצוות כרומוזומים
מנגנוני המעבר בין מצבי כרומטין
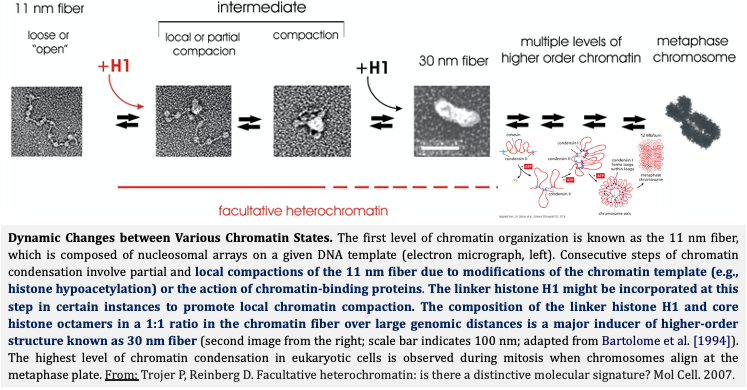
המעבר מהטרוכרומטין פקולטטיבי לאוכרומטין כולל מספר שלבים מתואמים:
-
שלב 1: איתות ראשוני
- קישור חלבוני שעתוק לאלמנטים רגולטוריים
- גיוס אנזימי מודיפיקציה (למשל demethylases)
-
שלב 2: שינוי קוד היסטון
- הסרת מודיפיקציות “סוגרות” (H3K9me3, H3K27me3)
- הוספת מודיפיקציות “פותחות” (H3K4me3, H3K27ac)
-
שלב 3: גיוס מחליקי כרומטין
- פעילות קומפלקסי SWI/SNF
- החלפת וריאנטי היסטון
-
שלב 4: ייצוב מצב פתוח
- גיוס מכונת השעתוק
- שמירה על מודיפיקציות פתוחות
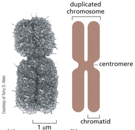
מבנה הכרומוזום המיטוטי
הכרומוזום כמבנה ארעי
חשוב להדגיש שהכרומוזומים בצורתם המוכרת (צורת X) נראים רק במהלך המיטוזה, כאשר הכרומטין עובר דחיסה מקסימלית. במצב הרגיל של התא (אינטרפאזה), הכרומטין מפוזר בגרעין כאוכרומטין והטרוכרומטין.
מתי נראים כרומוזומים מובחנים:
- פרופאזה - התחלת הקונדנסציה
- מטאפאזה - דחיסה מקסימלית וסידור על הציר
- אנאפאזה - הפרדת כרומטידים אחות
- משך כולל: 3-2 שעות מתוך מחזור תא של 24-20 שעות
אנטומיה של הכרומוזום המיטוטי
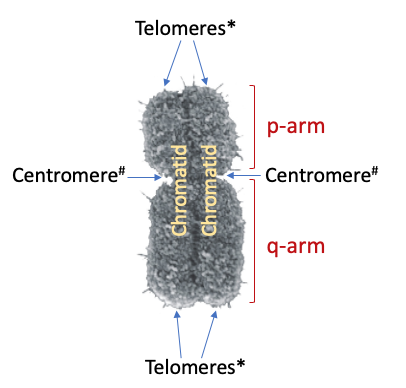
הצנטרומר - מרכז הבקרה
הצנטרומר הוא האזור המחבר בין שני הכרומטידים האחות ומורכב מ:
- רצפי DNA חוזרים מיוחדים (alpha satellite DNA באדם)
- חלבונים ספציפיים לצנטרומר:
- CENP-A (מחליף את היסטון H3)
- CENP-B, CENP-C (חלבוני קישור)
- חלבוני הקינטוכור
- מבנה הקינטוכור - הממשק לקישור הציר המיטוטי
זרועות הכרומוזום
על בסיס מיקום הצנטרומר, הכרומוזום מתחלק לזרועות:
- זרוע P (p-arm):
- נגזרת מ-“petite” (קטן בצרפתית)
- הזרוע הקצרה יותר
- מכילה בדרך כלל פחות גנים
- זרוע Q (q-arm):
- האות הבאה באלפבית אחרי P
- הזרוע הארוכה יותר
- מכילה בדרך כלל יותר גנים
הטלומרים - מגני הקצוות
בקצוות הכרומוזום נמצאים הטלומרים, המורכבים מ:
- רצפי DNA חוזרים (TTAGGG באדם)
- חלבוני הגנה (שלטרין - shelterin complex)
- תפקיד הגנתי - מניעת היתוך כרומוזומים והכרה כ-DNA שבור
סיווג כרומוזומים לפי מיקום הצנטרומר

כרומוזומים מטאצנטריים
- הצנטרומר במרכז או קרוב למרכז
- יחס בין זרועות קרוב ל-1:1
- דוגמאות: כרומוזומים 1, 3, 16, 19, 20
כרומוזומים תת-מטאצנטריים
- הצנטרומר מוזז מהמרכז
- יחס בין זרועות בין 1:1.5 ל-1:3
- דוגמאות: כרומוזומים 2, 4, 5, 6, 7, 8, 9, 10, 11, 12, 17, 18, X
כרומוזומים אקרוצנטריים
- הצנטרומר כמעט בקצה
- זרוע P קטנה מאוד או כמעט לא נראית
- דוגמאות: כרומוזומים 13, 14, 15, 21, 22, Y
- מכילים גנים ריבוזומליים בזרוע P הקטנה
גופיפי הגרעין ואברוני הפונקציה
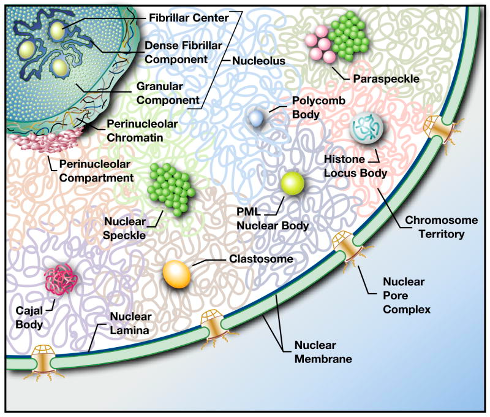
The Nuclear Interior: The Nuclear Bodies
Nuclear bodies (NBs) are non-membrane bound structures in the nucleoplasm that fulfill the following requirements:
- they are microscopically visible (at least during some periods of the cell cycle);
- they concentrate specific nuclear factors, i.e., proteins and RNAs;
- they constantly exchange their components with the surrounding nucleoplasm.
*The last condition discriminates NBs from protein aggregates that form in the nucleus during certain pathologies, e.g., amyloid plagues.
(from the professor’s slides)
קונדנסטים ביולוגיים - פרדיגמה חדשה
הגרעין מכיל מספר רב של מבנים הנקראים גופיפי גרעין (Nuclear Bodies), המייצגים צורה חדשה של ארגון תאי הנקראת קונדנסטים ביולוגיים. מבנים אלו מתאפיינים ב:
מאפיינים פיזיים:
- חסרי ממברנה - לא מוקפים בקרום ביולוגי
- צפופים מקומית - ריכוז גבוה של מולקולות ספציפיות
- כדוריים או אליפסואידיים בצורתם
- בגדלים משתנים - בין 5-0.1 מיקרומטר בקוטר
מאפיינים דינמיים:
- יצירה דינמית - יכולים להיווצר ולהתפרק בהתאם לצרכים
- נגישות גבוהה - מולקולות יכולות להיכנס ולצאת בחופשיות
- תלות בריכוז - נוצרים כאשר הריכוז של רכיבים חוצה סף מסוים
- תגובה לאותות - מגיבים לשינויים תאיים ופיזיולוגיים
הבדלה מאגרגטים פתולוגיים:
בניגוד לאגרגטים החלבוניים הפתולוגיים (כמו באלצהיימר או בפרקינסון):
- קונדנסטים ביולוגיים הפיכים ונגישים
- אגרגטים פתולוגיים בלתי הפיכים וצפופים
הנוקלאולוס - מרכז סינתזת הריבוזומים
הנוקלאולוס הוא הגוף הגרעיני הבולט והגדול ביותר, ומהווה דוגמה מושלמת לקונדנסט ביולוגי פונקציונלי.
מיקום ומבנה:
- נמצא בדרך כלל בקרבת מספר כרומוזומים (13, 14, 15, 21, 22)
- מורכב משלושה אזורים נפרדים:
- FC (Fibrillar Center) - מכיל גנים ריבוזומליים
- DFC (Dense Fibrillar Component) - עיבוד מוקדם של rRNA
- GC (Granular Component) - הרכבת תת-יחידות ריבוזומליות
תהליכי הביוגנזה הריבוזומלית
-
שלב 1: שעתוק rRNA
- שעתוק גנים ריבוזומליים על ידי RNA Polymerase I
- יצירת תרא-RNA 45S (pre-rRNA)
- מתרחש ב-FC ו-DFC
-
שלב 2: עיבוד rRNA
- חיתוך והסרת רצפים פנימיים (ITS - Internal Transcribed Spacers)
- מודיפיקציות כימיות (pseudouridylation, methylation)
- מתרחש בעיקר ב-DFC
-
שלב 3: הרכבת תת-יחידות
- צירוף חלבונים ריבוזומליים ל-rRNA מעובד
- יצירת תת-יחידות 40S ו-60S
- מתרחש ב-GC
-
שלב 4: ייצוא והשלמת ההרכבה
- ייצוא תת-יחידות דרך נקבוביות הגרעין
- מיקוד לרשת האנדופלזמטית הגסה
- הרכבה סופית לריבוזומים פעילים
וויסות פעילות הנוקלאולוס
גודל ופעילות הנוקלאולוס משקפים את הצורך התאי בריבוזומים:
- תאים מתחלקים במהירות - נוקלאולוס גדול ופעיל
- תאים בדיפרנציאציה - נוקלאולוס קטן יותר
- תאים במנוחה - נוקלאולוס מזערי
גופיפי גרעין נוספים
Cajal Bodies:
- מתמחים בעיבוד snRNAs ו-snoRNAs
- חשובים לתפקוד הספלייסאוזום
- קשורים לגנים המקודדים להיסטונים
Nuclear Speckles:
- מכילים חלבוני ספלייסינג
- אתרי אחסון ועיבוד של מכונת הספלייסינג
- דינמיים במיוחד במהלך השעתוק
PML Bodies:
- מעורבים בתגובת לחץ תאי
- קשורים לתיקון DNA ולאפופטוזיס
- מטרה של חלבונים ויראליים מדכאים
Histone Locus Bodies:
- מתמחים בעיבוד mRNAs של היסטונים
- פעילים במיוחד בשלב S של מחזור התא
- חשובים לסינכרון סינתזת ההיסטונים עם שכפול DNA
אינטגרציה: מבנה-תפקוד ברמת הגרעין
הארגון המרחבי של הגרעין
הגרעין אינו מרחב אחיד אלא בעל ארגון מרחבי מדויק:
פריפריה גרעינית:
- עשירה בהטרוכרומטין קונסטיטוטיבי
- אזור של השתקת גנים
- קשורה לחלבוני הלמינה
אזורים פנימיים:
- עשירים באוכרומטין ובגופיפי גרעין פעילים
- אזורי שעתוק אקטיביים
- ריכוז מכונת השעתוק והעיבוד
התארגנות כרומוזומלית:
כל כרומוזום תופס “טריטוריה” מוגדרת בגרעין:
- כרומוזומים שונים ממוקמים באזורים נפרדים
- אינטראקציות בין-כרומוזומליות מוגבלות יחסית
- ארגון זה חשוב למניעת טרנסלוקציות
דינמיקה תאית ושינויי מבנה
במהלך מחזור התא:
שלב G1:
- כרומטין במצב בינוני של דחיסה
- פעילות שעתוק גבוהה
- גופיפי גרעין פעילים
שלב S:
- פתיחה מקומית לשכפול DNA
- פעילות נוקלאולוס גבוהה (סינתזת היסטונים)
- דינמיקה גבוהה של מחליקי כרומטין
שלב G2:
- הכנה לקונדנסציה
- הפחתה בפעילות שעתוק
- התחלת הרכבת מכונת הקונדנסציה
מיטוזה:
- קונדנסציה מקסימלית
- פירוק גופיפי הגרעין
- פירוק המעטפת הגרעינית
תיקון נזקי DNA והכרומטין
הכרומטין משחק תפקיד מכריע בתיקון נזקי DNA:
זיהוי הנזק:
- חלבונים מזהי נזק צריכים נגישות ל-DNA
- מחליקי כרומטין נגוסים לאתר הנזק
- מודיפיקציות מיוחדות (H2A.X phosphorylation)
תהליך התיקון:
- פתיחה מקומית של הכרומטין
- גיוס חלבוני תיקון לאתר הנזק
- ביצוע התיקון המולקולרי
- סגירה מחדש של הכרומטין
חשיבות הארגון
התזמון של פתיחה וסגירה חיוני:
- פתיחה ממושכת עלולה לגרום לאי-יציבות
- סגירה מהירה מדי עלולה למנוע תיקון מלא
השלכות רפואיות ותרפויטיות
מחלות הקשורות לחלבוני כרומטין
מוטציות בחלבוני היסטון:
- סרטנים המאופיינים בפעילות-יתר של H3K4me3 demethylase
- מחלות נוירודגנרטיביות הקשורות לחלבוני תגובת סטרס
מוטציות במחליקי כרומטין:
- תסמונות התפתחותיות חמורות
- סרטנים מאופיינים בקומפלקסי SWI/SNF פגועים
- מחלות אוטואימוניות
טיפולים אפיגנטיים
מעכבי מתילטרנספרזות:
- 5-azacytidine ו-decitabine
- פותחים כרומטין דחוס
- מאושרים לטיפול בסרטנים מסוימים
מעכבי היסטון דיאצטילזות (HDACi):
- Vorinostat, Romidepsin
- מגבירים אצטילציה ופותחים כרומטין
- יעילים בלימפומות מסוימות
מעכבי מתילטרנספרזות היסטון:
- EPZ-6438 (מעכב EZH2)
- מטפלים בסרטנים עם מוטציות במטילטרנספרזות H3K27me3
אסטרטגיות טיפול עתידיות
עריכה אפיגנטית ממוקדת:
- שימוש בטכנולוגיית CRISPR/dCas9
- הכנסת מודיפיקציות ספציפיות למיקומים מדויקים
- פוטנציאל לטיפול במחלות מונוגניות
תרפיה משולבת:
- שילוב מעכבי אפיגנטיקה עם כימותרפיה
- טיפולים ממוקדי אימונותרפיה
- התאמה אישית על בסיס פרופיל אפיגנטי
סיכום והשלכות
מבנה הגרעין והכרומטין מייצג אחד המערכות הביולוגיות המורכבות והמתוחכמות ביותר בטבע. הארגון ההיררכי של המידע הגנטי, החל מנוקלאוזומים בודדים ועד לארגון הכרומטין בחלל התלת-ממדי של הגרעין, מאפשר שליטה מדויקת בביטוי גנים ובתפקוד התא.
ההבנה העמוקה של מערכות אלו פותחת פתחים חדשים ברפואה המודרנית, במיוחד בתחום הטיפולים האפיגנטיים שמתמקדים בשינוי מצב הכרומטין במקום בשינוי רצף ה-DNA עצמו. בעוד שאנו רק בתחילת הדרך להבנה מלאה של המורכבות הזו, ברור שעקרונות הארגון הכרומטיני יהיו בבסיס הבנתנו את התפתחות המחלות ופיתוח טיפולים חדשים בעשורים הקרובים.
העובדה שבכל רגע נתון מתרחשים מיליארדי תהליכים של פתיחה וסגירה של כרומטין ברחבי הגוף האנושי, כאשר כל תא מתמודד עם מאות נזקי DNA בכל שעה, מדגישה את הרמה הבלתי נתפסת של הסינכרון והבקרה הקיימת במערכות הביולוגיות. הבנת מערכות אלו היא לא רק הישג מדעי מרשים אלא גם המפתח לפיתוח הדור הבא של הטיפולים הרפואיים.
דור פסקל