הערה מקדימה - לפי האקדמיה ללשון העברית:
אלוציה (Elution) - הַשְׁטָפָה (שטיפת חומר ספוח על־ידי המסה)
אלקטרופורזה בג׳ל (SDS-PAGE)
עקרונות בסיסיים
- SDS (Sodium Dodecyl Sulfate) - דטרגנט יוני שכולל:
- קבוצת סולפט ($\ce{SO4-}$)
- שרשרת ארוכה של פחמנים (חלק הידרופובי)
- SDS הורס את המבנה הקוואטרנרי של החלבון ומנטרל את הצורה הטבעית (״נטיבית״ - מלשון Native)
- החלבונים נפרסים לשרשראות ליניאריות
תכונות SDS
- יחס קבוע: מולקולת SDS אחת נקשרת לכל 2 חומצות אמינו
- נותן לכל החלבונים צפיפות מטענית שווה (שלילית)
- מנטרל את המטענים הטבעיים של החלבון
- החלבונים נעים רק לפי משקל מולקולרי
חומרים מחזרים
תמיד מוסיפים חומרי חיזור כמו:
- DTT (Dithiothreitol)
- β-mercaptoethanol
שתי סיבות להוספת חומרים מחזרים:
- חלבונים עם קשרי דיסולפיד: פירוק הקשרים ליצירת שרשרת אחת מקופלת
- חלבונים עם ציסטאינים חופשיים: מניעת יצירת קשרי דיסולפיד לא ספציפיים שגורמים לאגרגציה
הליך העבודה
- חימום הדגימה ב-SDS למשך 5 דקות (דנטורציה מלאה)
- ההרצה מתבצעת בזרם חשמלי
- גודל הנקבוביות בג׳ל קובע את מהירות הריצה ויכולת ההפרדה
קביעת משקל מולקולרי
- הרצת מרקר - תערובת חלבונים במשקלים ידועים
- מדידת מרחק הנדידה לאחר זמן נתון
- יצירת גרף סמי-לוגריתמי: נפח אלוציה אל מול הלוגריתם של המשקל המולקולרי
- קבלת קו ישר והערכת משקל החלבון הלא ידוע
הערה חשובה: זהו המשקל הדנטורטיבי (שרשרת אחת). אם החלבון הנטיבי הוא אוליגומר (למשל דיימר), יראה משקל שונה בשיטות נטיביות.
ג׳ל דו-ממדי (2D Gel Electrophoresis)
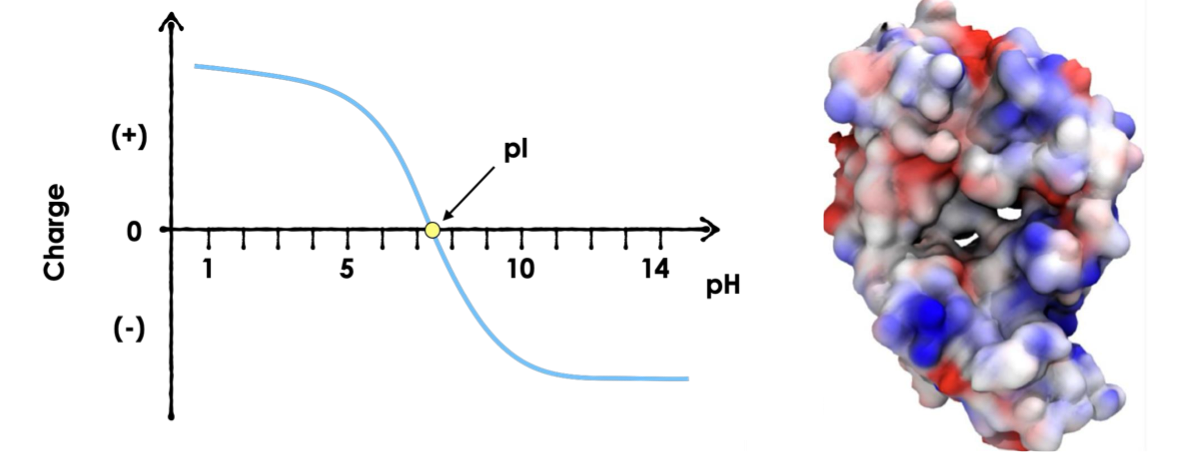
ממד ראשון - הפרדה לפי $\text{pI}$
$\text{pI}$ = Point Isoelectric
total net charge = 0, but not necessarily neutral groups
- הרצה על פס עם גרדיאנט $\text{pH}$ (למשל
pH 3-9) - כל חלבון נע עד שמגיע ל-$\text{pI}$ שלו (נקודה איזואלקטרית)
- ב-$\text{pI}$: המטען נטו = 0, החלבון עוצר
- הרצה נטיבית (בצורה המקופלת)
ממד שני - הפרדה לפי גודל
- סיבוב הג׳ל ב-90° והנחה על ג׳ל SDS-PAGE
- הרצה דנטורטיבית לפי משקל מולקולרי
- תוצאה: נקודות המייצגות חלבונים שונים
יישום: הפרדה של חלבונים עם משקל מולקולרי שונה אך אותו $\text{pI}$
צביעה וזיהוי
שיטות צביעה
- Coomassie Brilliant Blue (CBB) - צביעה סטנדרטית
- Silver Stain - רגישות פי-10 יותר גבוהה, יקרה יותר
Western Blot
- העברת חלבונים מהג׳ל לממברנת ניטרוצלולוז
- זיהוי חלבון ספציפי באמצעות נוגדנים
- רגישות גבוהה - רואים רק את החלבון המבוקש גם בדגימה “מלוכלכת”
ריצוף חלבון
- גזירת בנדים מהג׳ל
- שליחה לניתוח בספקטרוסקופיית מסה (Mass Spectrometry)
- זיהוי וריצוף החלבון
הפרדת חלבונים
שלבים ראשונים
- שבירת תאים - שיטות מכניות + דטרגנטים עדינים (לא SDS)
- צנטריפוגה (centrifugation) - הפרדת:
- פלט (pellet): חומר לא מסיס, ממברנות
- סופרנטנט (supernatant): חלבונים מסיסים בנוזל הציטופלזמי
שקיעה סלקטיבית (Selective Precipitation)
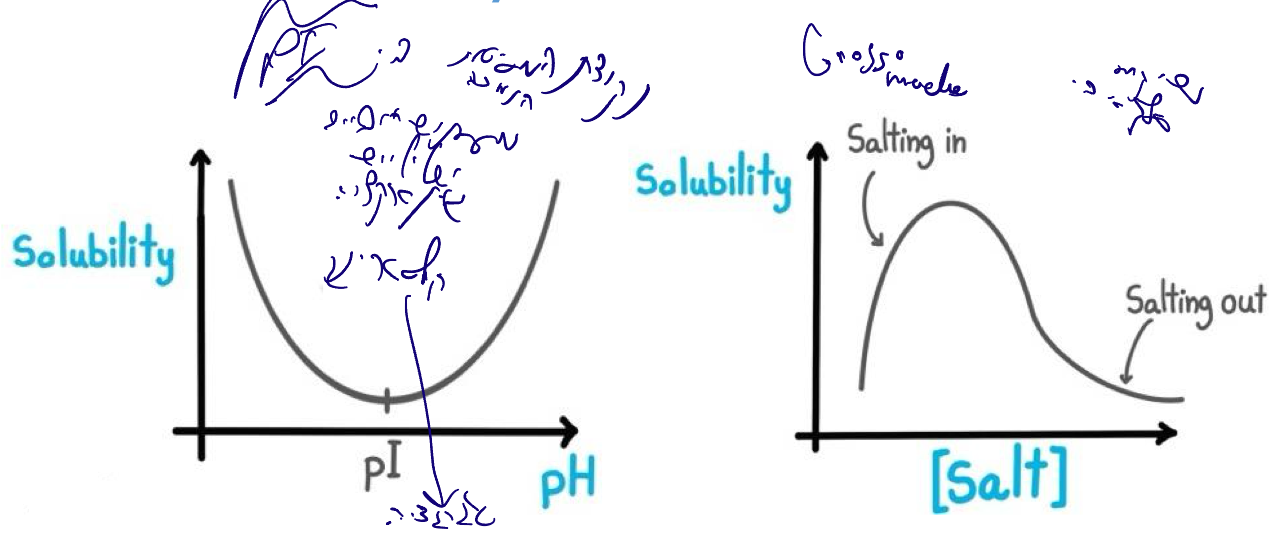
Solubility based purification
עקרונות
- שימוש בתכונות המסיסות של חלבונים
- $\text{pI}$ = נקודת המסיסות הנמוכה ביותר
- ב-$\text{pI}$: מספר שווה של מטענים חיוביים ושליליים
- אינטראקציות אלקטרוסטטיות בין חלבונים ← קלסטרינג (Clustering) ושקיעה
- משתנים: $\text{pH}$ וריכוז מלח
השפעת מלח
Salting In (ריכוזי מלח נמוכים):
- יצירת מיסוך יוני על מטעני החלבון
- מעטפת הידרציה טובה יותר
- עלייה במסיסות
Salting Out (ריכוזי מלח גבוהים):
- תחרות בין יוני המלח לחלבון על מולקולות מים
- החלבון נשאר ללא מעטפת הידרציה
- אגרגציה ושקיעה
דיאליזה (Dialysis)
עקרון הפעולה
- שקית עם cut-off מסוים (למשל
25 kDa) - ממברנה חדירה למחצה
- דיפוזיה של מולקולות קטנות מהשקית החוצה
- מולקולות גדולות נשארות בשקית
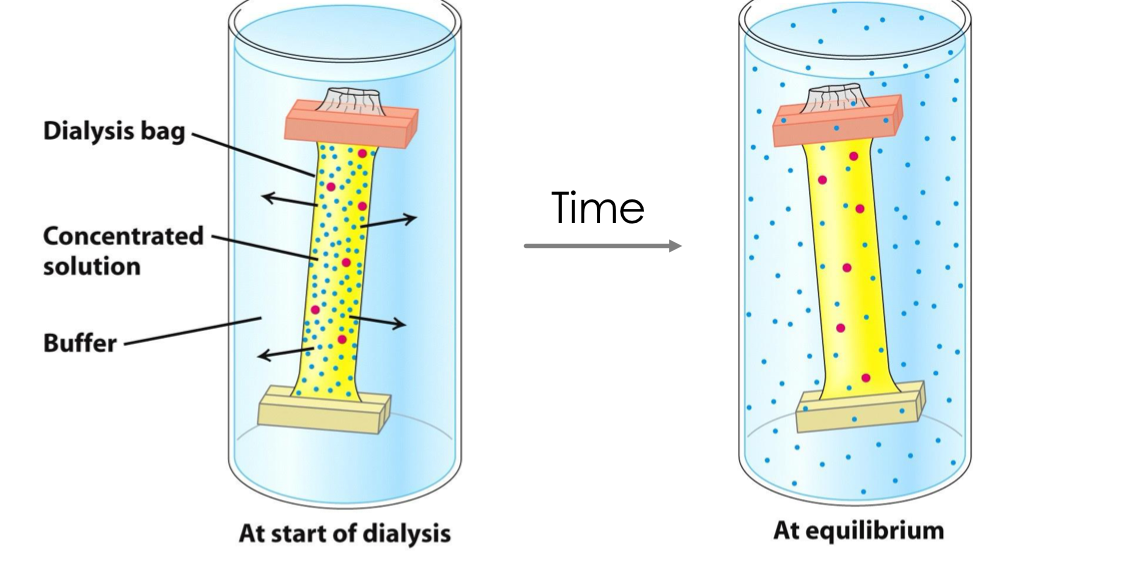
יישומים
- דילול מולקולות קטנות - מספר מחזורי דיאליזה (בדרך כלל 3)
- החלפת באפר - דיאליזה נגד באפר חדש
הערה: בחירת cut-off לפחות במחצית משקל החלבון המבוקש
כרומטוגרפיה
עקרון כללי
העברת דגימה דרך פאזה נייחת $\text{(stationary phase)}$ עם תכונה ספציפית
1. Size Exclusion Chromatography (SEC) / Gel Filtration
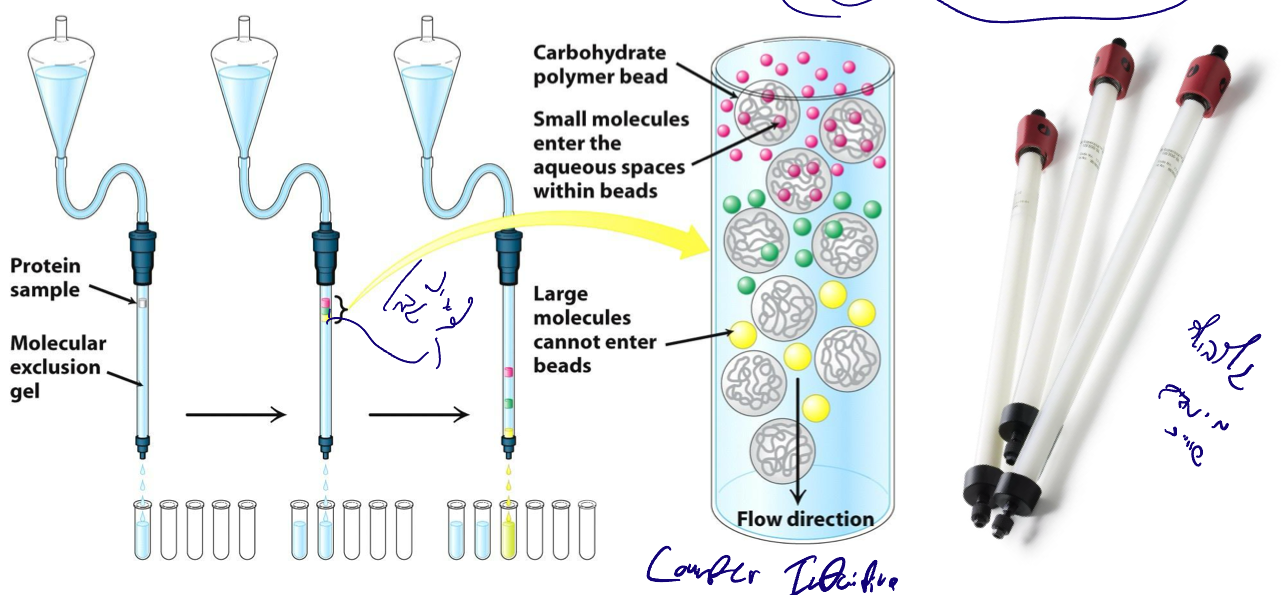
מבנה הקולומנה
- כדוריות (beads) עשויות פולימר אינרטי
- הכדוריות בנויות כרשת ספוגית
מנגנון ההפרדה (counter-intuitive!)
- חלבונים גדולים: לא נכנסים לרשתות ← עוברים בין הגרגירים ← רצים מהר ← יוצאים ראשונים
- חלבונים קטנים: נכנסים לרשתות ← מסתבכים ← עושים דרך ארוכה ← רצים לאט ← יוצאים אחרונים
איסוף ומדידה
- איסוף פרקציות במרווחי זמן קבועים
- מדידה: elution volume או elution time
- הרצה בג׳ל אלקטרופורזה לזיהוי החלבון
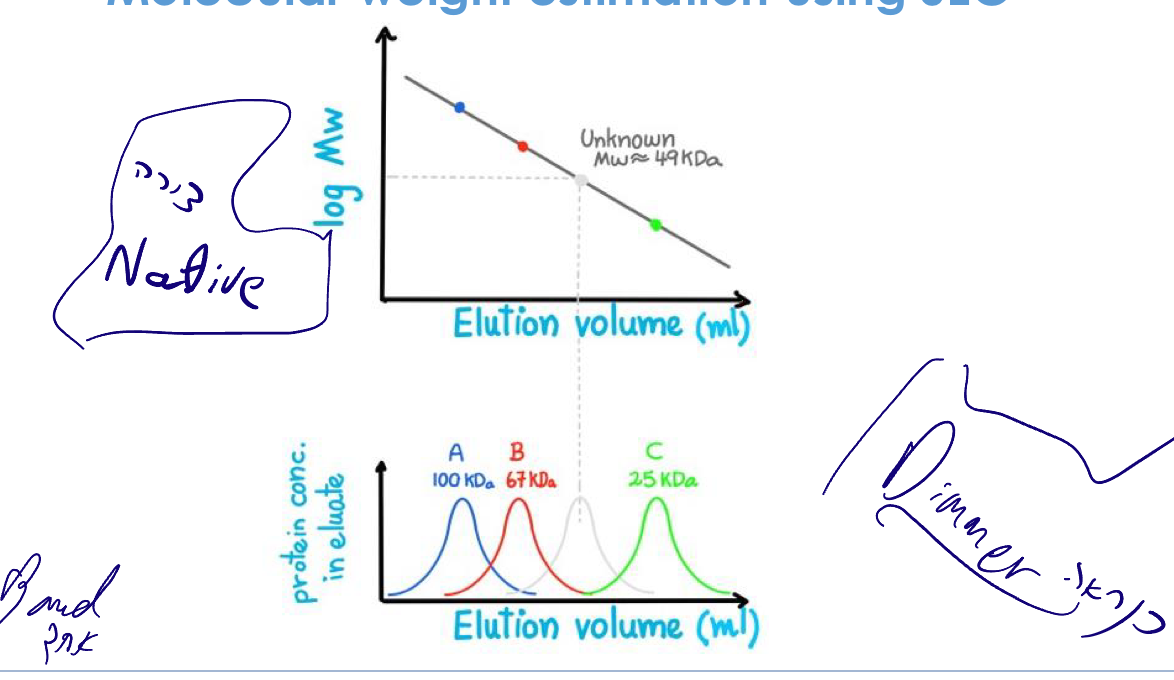
הערכת משקל מולקולרי
- הרצת חלבוני סטנדרט (משקלים ידועים)
- יצירת גרף: elution volume vs. log(MW)
- השוואה למדידה ב-SDS-PAGE
אזהרה: ההשוואה תקפה רק לחלבונים גלובולריים. חלבון מוארך ירוץ כמו חלבון גדול יותר (רדיוס הידרודינמי גדול).
2. Ion Exchange Chromatography (מחליף יונים)
עקרונות מטען
- בכל חלבון ב-$\text{pH}$ נתון: פוטנציאל מטעני מסוים
- $\text{pH}$ נמוך ← מטען חיובי
- $\text{pH} = \text{pI}$ ← מטען נטו = 0
- $\text{pH}$ גבוה ← מטען שלילי
סוגי מחלפי יונים
- Cation Exchange - גרגרים (beads) טעונים שלילית, קושרים חלבונים חיוביים
- Anion Exchange - גרגרים (beads) טעונים חיובית, קושרים חלבונים שליליים
הליך ההפרדה
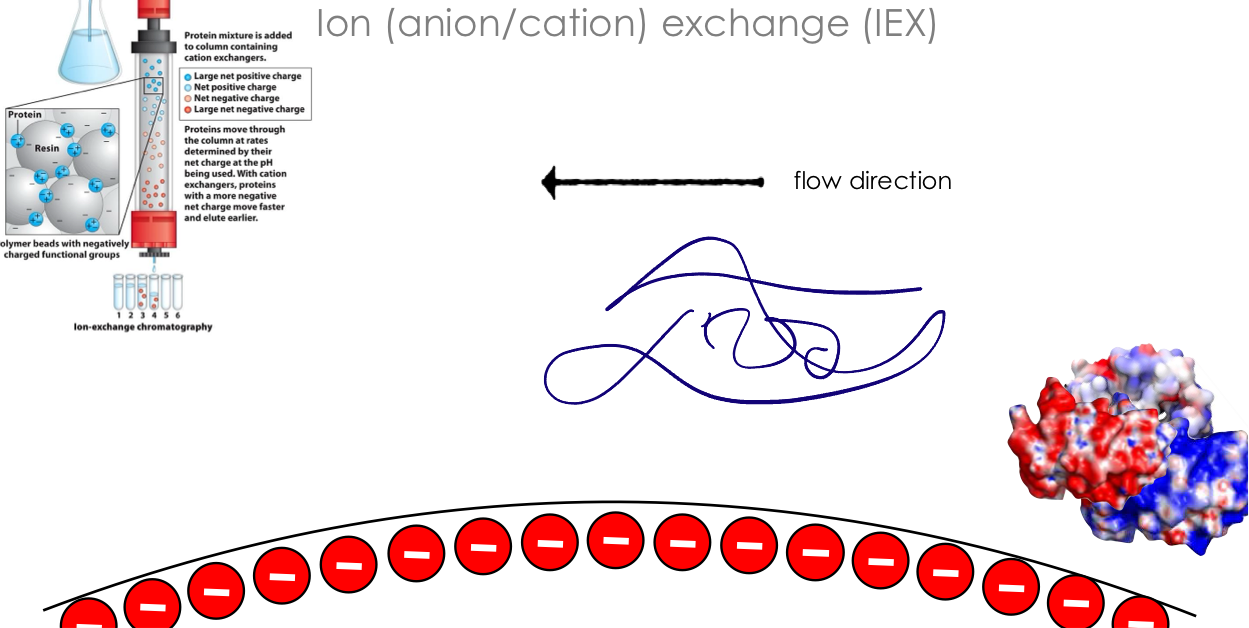
- טעינת הדגימה על הקולומנה
- חלבונים עם מטען מתאים נקשרים (חוזק הקשר תלוי במספר המטענים)
- חלבונים עם מטען הפוך שוטפים
- אלוציה בגרדיאנט מלח:
- ריכוז נמוך ← שחרור חלבונים שקשורים חלש
- ריכוז גבוה ← שחרור חלבונים שקשורים חזק
- יוני המלח מחליפים את החלבון כקטיון או כאניון על הקולומנה
3. Affinity Chromatography (כרומטוגרפיית זיקה)
עקרון
ניצול זיקה ספציפית של החלבון לליגנד מסוים
דוגמה: חלבון שקושר גלוקוז
- beads עם מולקולות גלוקוז קשורות
- העברת תערובת חלבונים
- רק החלבון שקושר גלוקוז נקשר
- שאר החלבונים שוטפים
שיטות אלוציה
א. אלוציה תחרותית (Competitive Elution)
- הוספת גלוקוז חופשי בריכוז גבוה
- תחרות על הליגנד הקשור
- הסטת שיווי משקל ← החלבון יוצא קשור לגלוקוז חופשי
ב. אלוציה לא-ספציפית
- שינוי pH (חומצי/בסיסי קיצוני)
- הוספת מלח בריכוז גבוה
- חומרים דנטורנטים (urea, guanidine)
- חיסרון: עלול להרוס את החלבון ואת הליגנד
ג. תחרות על הליגנד
- מולקולה חוסמת את הליגנד במקום החלבון
- החלבון משתחרר חופשי (ללא ליגנד)
דוגמה מיוחדת: נוגדן-אנטיגן
- קישור חזק מאוד
- בדרך כלל דורש $\text{pH}$ נמוך ($\sim 2$) לשחרור
- נוגדנים יציבים ושורדים תנאים קיצוניים
המוגלובין ומיוגלובין
חשיבות נשאי חמצן
בעיית המסיסות
- $\ce{O=O}$ היא מולקולה לא פולארית ($\Delta = 0$)
- מסיסות נמוכה במים: בערך $0.15 \, \mathrm{mM}$ באיזון עם אוויר
- $\ce{CO2}$ ו-$\ce{NH3}$ מסיסים פי-30 יותר (מולקולות פולאריות)
פתרון אבולוציוני
- מעבר מחיים במים ליבשה ← צורך בהסעת חמצן למרחקים
- דיפוזיה לבד אינה יעילה למרחקים ארוכים
- פיתוח נשאי חמצן: המוגלובין ומיוגלובין
השפעת נשאי חמצן
- ללא המוגלובין: מסיסות $\ce{O2} = 5 \, \mathrm{mL/L}$
- עם המוגלובין: מסיסות $\ce{O2} = 250 \, \mathrm{mL/L}$
- פי-50 עלייה במסיסות!
תכונות נשא
- קישור לחומר הנישא בתנאים מסוימים (בריאות)
- שחרור החומר בתנאים אחרים (ברקמות)
- קישור לא-קובלנטי והפיך
מבנה המוגלובין/מיוגלובין
רכיבים
- קבוצה פרוסתטית - Heme (תרכובת
porphyrinעם ברזל במרכז) - גלובין - החלבון
Heme - מבנה ותכונות
מבנה:
- 4 טבעות פירול שמחוברות במבנה מחזורי
- אטום ברזל ($\ce{Fe^{2+}}$) במרכז
- הברזל נקשר ב-4 קשרים קואורדינטיביים לחנקנים של הפירולים
קשרים קואורדינטיביים:
- קשר שבו שני האלקטרונים מגיעים מאותו אטום
- הברזל מקבל זוג אלקטרונים מכל חנקן
- שני מקומי קישור נוספים לברזל:
- קישור להיסטידין פרוקסימלי (F8)
- מקום פנוי/קישור ל-$\ce{O2}$ או מים
מבנה תלת-ממדי
מיוגלובין:
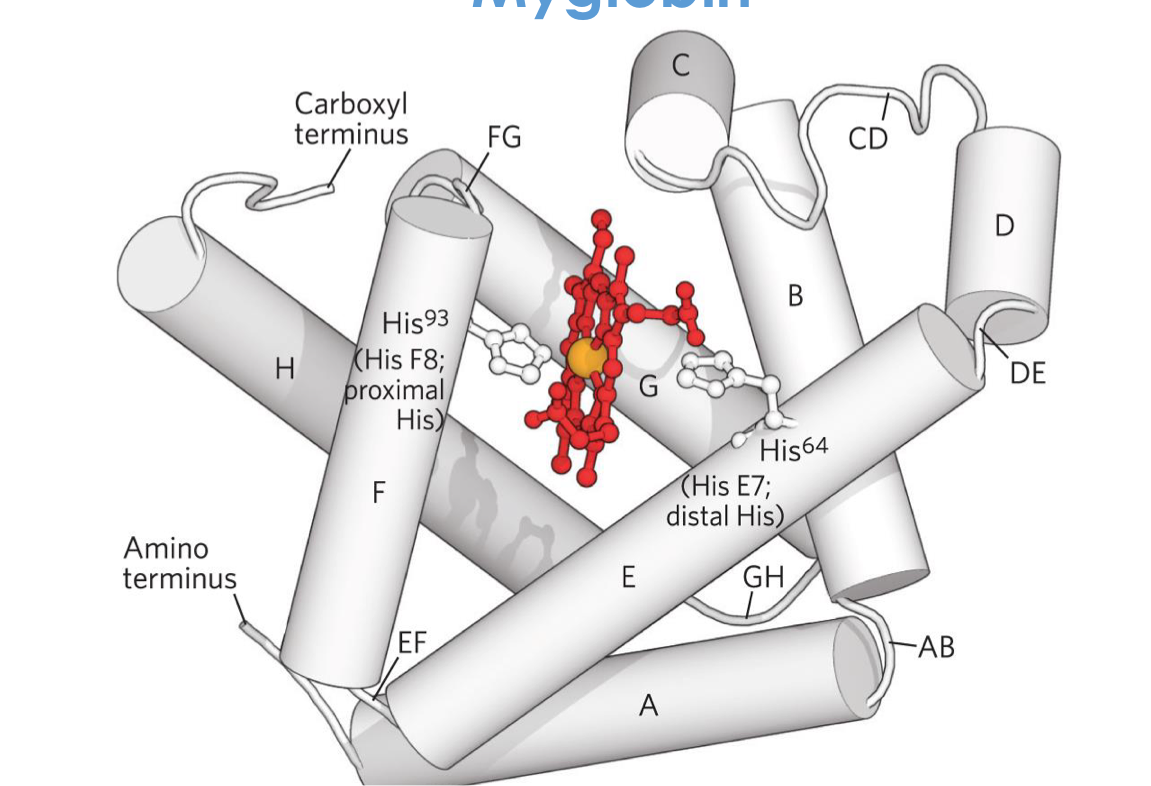
- מונומר (שרשרת יחידה)
8 α-helices- 153 חומצות אמינו
- כיס הידרופובי לקבוצת Heme
- משקל: בערך $~17 \, \mathrm{kDa}$
המוגלובין:
- טטרמר: $\alpha_2\beta_2$
- שתי שרשראות α (141 a.a. כל אחת)
- שתי שרשראות β (146 a.a. כל אחת)
- 4 קבוצות Heme (אחת לכל תת-יחידה)
- משקל: $~64 \, \mathrm{kDa}$
קישור חמצן
מצבי חמצון
- Ferrous ($\ce{Fe^{2+}}$) - קושר $\ce{O2}$ באופן הפיך ✓
- Ferric ($\ce{Fe^{3+}}$) - לא יכול לקשור $\ce{O2}$ ✗
הסביבה ההידרופובית
- כיס Heme הידרופובי מגן על הברזל
- מונע חמצון ל-$\ce{Fe^{3+}}$
- מאפשר קישור הפיך של $\ce{O2}$
היסטידינים קריטיים
- His F8 (פרוקסימלי): קושר ישירות לברזל
- His E7 (דיסטלי): מייצב את $\ce{O2}$ הקשור, מונע קישור של $\ce{CO}$
המשך יבוא בשיעור הבא
- עקומות קישור חמצן
- Cooperativity
- אפקט Bohr
2,3-BPG- הבדלים תפקודיים בין מיוגלובין להמוגלובין
מונחים נוספים:
- Native - נטיבי (צורה טבעית)
- Denatured - דנטורטיבי (צורה מפורקת)
- Elution - אלוציה (יציאה מקולומנה)
- Ligand - ליגנד (מולקולה נקשרת)
- Prosthetic group - קבוצה פרוסתטית