מושגי יסוד בקישור ליגנדים
Ligands bind protein on a wide range of $K_{\text{d}}$ values.
הגדרות בסיסיות
- $K_{\text{d}}$ (קבוע דיסוציאציה) - ערך ללא יחידות שמבטא יחס, נותן מדד לאפיניות.
- הבהרה לאחר קריאת הספר: $K_{\text{d}}$ הוא ריכוז הליגנד (ביחידות של מולר) שבו חצי מהאתרים תפוסים. כלומר, ערך נמוך של $K_{\text{d}}$ מצביע על אפיניות גבוהה (כי צריך פחות ליגנד כדי לתפוס חצי מהאתרים).
- $Y$ - מספר האתרים התפוסים חלקי סך כל האתרים הקיימים
- ערך $K_{\text{d}}$ נמוך - אפיניות גבוהה - High Affinity - מספר מאוד קטן ($10^{-16}$). כלומר, כמעט כל הליגנדים קשורים לחלבון, כי מספיק מעט מאוד ליגנד כדי לתפוס חצי מהאתרים.
- ערך $K_{\text{d}}$ גבוה - אפיניות נמוכה - Low Affinity - מספר יחסית גדול ($10^{-2}$). צריך ריכוז גבוה של ליגנד כדי לתפוס חצי מהאתרים.
משוואת הקישור
משוואת הקישור הבסיסית:
\[Y = \frac{\text{binding sites occupied}}{\text{total binding sites}} = \cdots = \frac{\left[\text{L}\right]}{\left[\text{L}\right] + K_{\text{d}}}\]כאשר:
- $Y$ = חלק האתרים התפוסים
- $\left[\text{L}\right]$ = ריכוז הליגנד
- $K_{\text{d}}$ = קבוע הדיסוציאציה
הפונקציה היא היפרבולית עם רוויה - ככל שמעלים את ריכוז הליגנד מגיעים לרוויה.
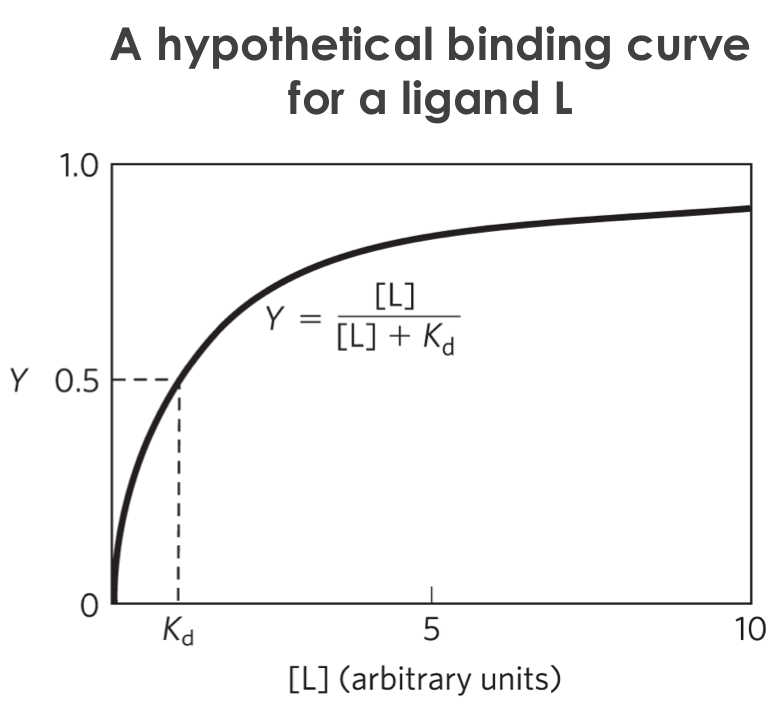
מדוע לא מגיעים ל-100% תפוסה?
הקישור הוא בשיווי משקל (לא קישור קוולנטי): התהליך הולך לשני הכיוונים כל הזמן, לכן לא יכול להיות מצב של 100% תפוסה. במצבים קיצוניים, נדרשים ריכוזי ליגנד כה גבוהים שרוב הליגנדים אינם מסיסים.
מיוגלובין
מבנה
- חלבון בודד של 16 קילודלטון (שרשרת אחת)
- מכיל טבעת הם (Heme) במרכזו
- שני היסטידינים חשובים:
- היסטידין 93 - היסטידין פרוקסימלי
- היסטידין 64 - היסטידין דיסטלי
- החמצן נקשר בין ההיסטידין הדיסטלי לברזל ($\ce{Fe^{2+}}$) במרכז טבעת ה-Heme. הקישור מושך את הברזל לכיוון הדיסטלי, נוצר מבנה מישורי.
תפקיד החלבון
למה צריך את החלבון ולא רק טבעת Heme חופשית?
הגנה מפני $\ce{CO}$:
- $\ce{CO}$ נקשר ל-Heme חופשי פי 20,000 יותר חזק מחמצן ($\ce{O2}$)
- אבל בתוך החלבון, $\ce{CO}$ נקשר רק פי 40 יותר חזק מחמצן
- זה מאפשר לנו לחיות בסביבה עם כמויות קטנות של $\ce{CO}$ (כמו גזי פליטה)
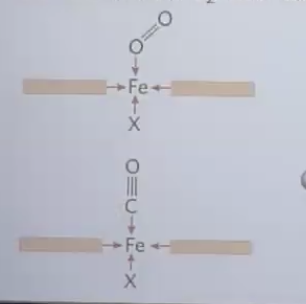
מייצר הגנה על ה-Heme שלא יתחמצן מדברים שאינם חמצן.
גרף קישור
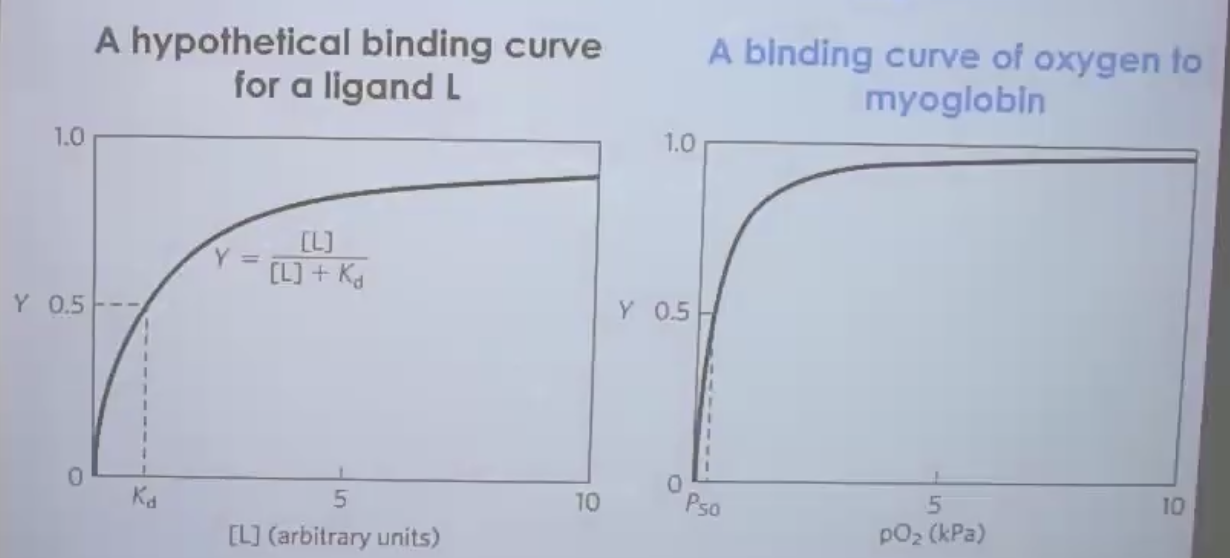
בצד שמאל גרף תיאורטי, בצד ימין המדידה בפועל.
מיוגלובין מציג גרף קישור היפרבולי קלאסי - בדיוק כמו שהתיאוריה מנבאת.
$P_{50}$ - הלחץ החלקי של חמצן שבו 50% מהאתרים תפוסים (שווה ל-$K_{d}$).
תפקיד ביולוגי
- אחסון חמצן בשרירים
- לא מעביר חמצן בכל הגוף, רק במיקרו-סביבה
- משחרר חמצן בתנאים ספציפיים ($\text{pH}$ וכו’)
המוגלובין
מבנה המוגלובין
- טטרמר - 4 תת-יחידות
- 2 שרשראות α (α1, α2)
- 2 שרשראות β (β1, β2)
- כל שרשרת מכילה טבעת Heme
- הרצפים של α זהים זה לזה, וכך גם של β
- אבל רצף α שונה מרצף β
שימור אבולוציוני
- ההיסטידינים שקושרים את ה-Heme שמורים בין כל השרשראות
- יש הבדלים ברצף (למשל, חסרים 5 Residues באזור מסוים ב-α)
- ההבדלים חשובים לתפקוד
צריך את השונות המבנית בשביל הפונקציה שהמוגלובין מתפקד.
שני מצבי קונפורמציה
$\text{T State}$ (Tense)
- דאוקסי-המוגלובין (ללא חמצן)
- Low affinity state - החמצן פחות נוטה להיקשר (עדיין נקשר, לפי הספר - פשוט באפיניות נמוכה יותר)
- הברזל נמשך מתחת למישור טבעת ה-Heme
$\text{R State}$ (Relaxed)
- אוקסי-המוגלובין (עם חמצן)
- High affinity state - החמצן נוטה להיקשר
- הברזל במישור טבעת ה-Heme
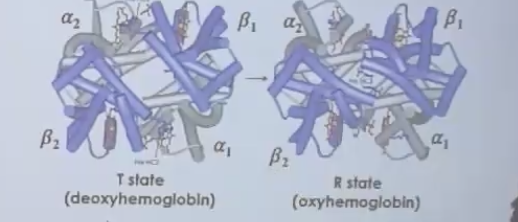
מנגנון השינוי הקונפורמטיבי
- חמצן נקשר לברזל
- האלקטרושליליות של החמצן מושכת את הברזל למעלה (לכיוון ההיסטידין הדיסטלי)
- הברזל מושך איתו את ההיסטידין הפרוקסימלי
- ההיסטידין מחובר לאלפא-הליקס ומושך אותו
- נוצר שינוי קונפורמטיבי בכל החלבון
אפקט אלוסטרי וקואופרטיביות
אפקט אלוסטרי
- אלוס = אחר, סטרי = צורה
- שינוי צורה ממקום אחר
- קישור באתר אחד גורם לשינוי קונפורמציה באתרים אחרים
- נפוץ באנזימים עם שרשראות רגולטוריות וקטליטיות
קואופרטיביות חיובית
- קישור הליגנד הראשון מעלה את האפיניות לליגנד השני
- התת-יחידה השנייה ״מוכנה״ יותר לקבל ליגנד
- יוצר עקומת קישור סיגמואידית (בצורת S)
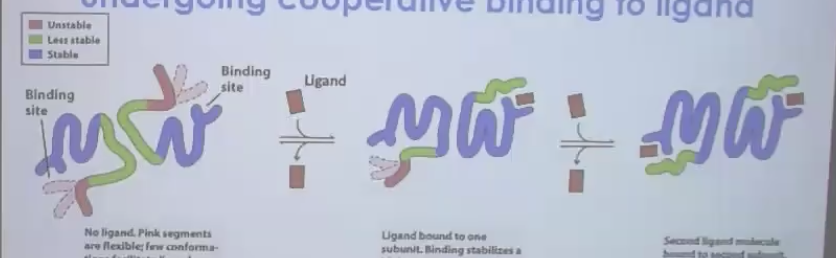
קישור של משהו שמעלה את האפיניות של תת יחידה שכנה - קואופרטיביות.
החשיבות הביולוגית
- בריאות: לחץ חמצן גבוה יחסית $\sim 13-14 \, \mathrm{kPa}$ ← אפיניות גבוהה לחמצן ← קישור יעיל של חמצן
- ברקמות: לחץ חמצן נמוך יחסית $\sim 4 \, \mathrm{kPa}$ ← אפיניות נמוכה לחמצן ← שחרור יעיל של חמצן
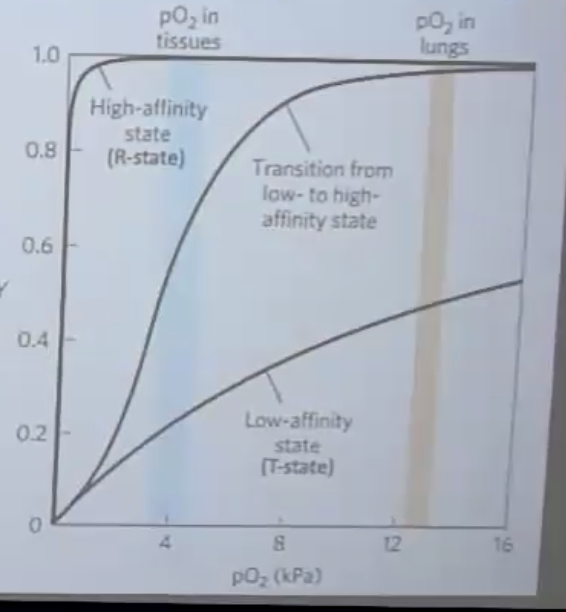
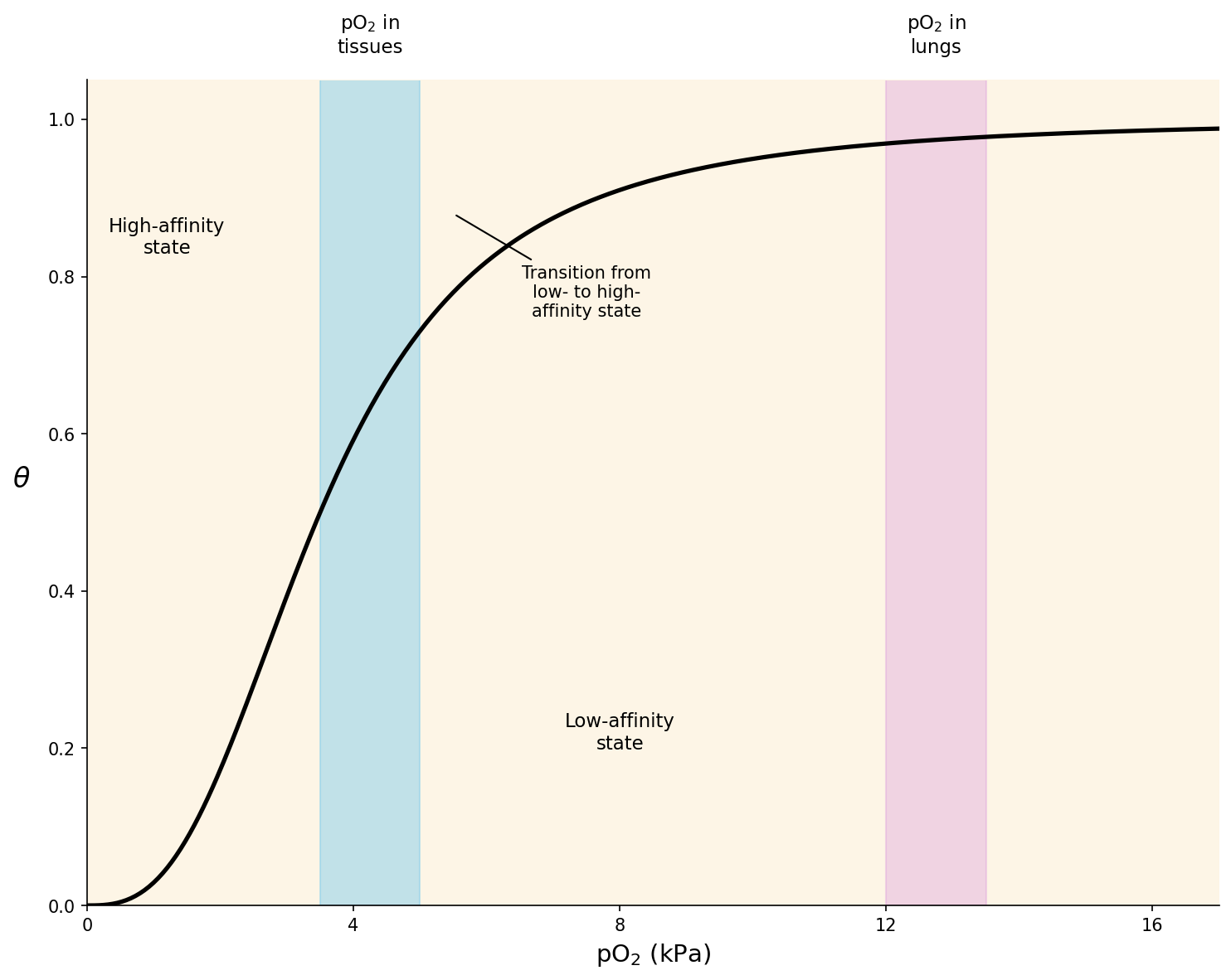
למה?
- אם ההמוגלובין היה תקוע ב-$\text{T State}$: לא היה קושר מספיק חמצן בריאות
- אם היה תקוע ב-$\text{R State}$: לא היה משחרר חמצן ברקמות
- הקואופרטיביות מאפשרת מעבר יעיל בין קישור בריאות לשחרור ברקמות
שאלות ותשובות מההרצאה
ש: למי יש אפיניות גבוהה יותר - חלבון עם $P_{50}$ נמוך או גבוה?
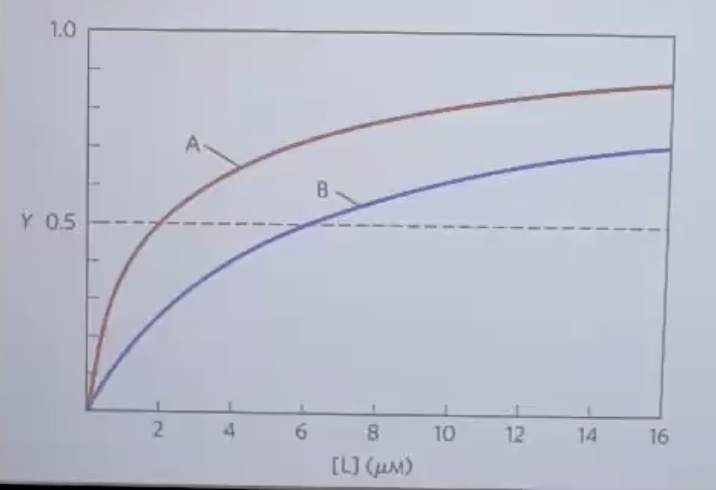
ת: חלבון עם $P_{50}$ נמוך (יותר שמאלה בגרף) = אפיניות גבוהה יותר. במקרה הזה ל-$\text{A}$ יש אפיניות גבוהה יותר. צריך לבדוק מי מגיע מוקדם יותר ל-50% תפוסה ($p50$).
ש: מה ההבדל בין K association ל-K dissociation?
ת: אלה מדדים קינטיים (כמה מהר נקשר/עוזב), אבל בהרצאה התמקדנו בשיווי משקל
ש: האם המעבר מ-T ל-R הוא transition אחד או כמה?
ת: תלוי במודל - יכול להיות אחד (MWC) או הדרגתי (Sequential)
המשך נושא המוגלובין - מודלים למעבר בין מצבים
מודלים לקואופרטיביות
יש שני מודלים עיקריים שמתארים את המעבר בין מצבי T ו-R:
- מודל
MWC (Monod-Wyman-Changeux)- “All or None”- כל הטטרמר עובר בבת אחת מ-$\text{T State}$ ל-$\text{R State}$
- מודל
Sequential- המעבר הדרגתי: תת-יחידה אחת משתנה, משפיעה על השכנה, וכך הלאה עד שכל החלבון ב-$\text{R State}$
הערה: ייתכנו מודלי ביניים (למשל α+β משתנות יחד, ואז הזוג השני)
גורמים המשפיעים על קישור חמצן להמוגלובין
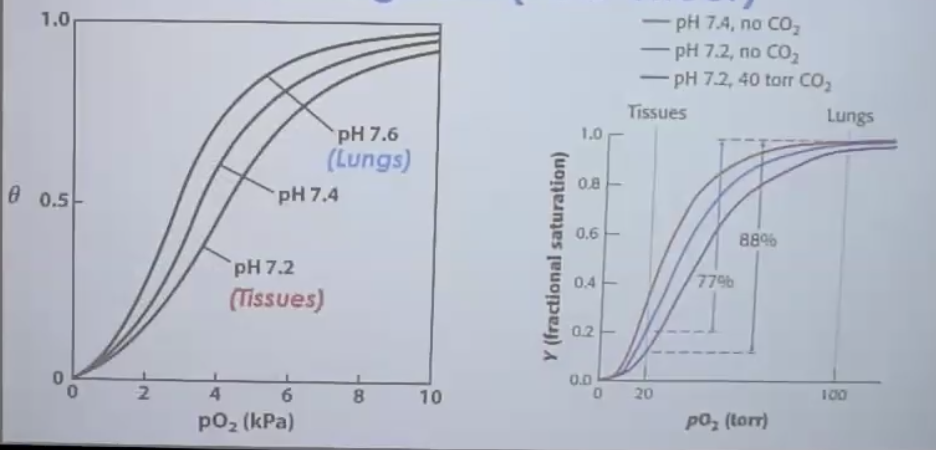
1. אפקט בוהר (Bohr Effect)
השילוב של $\text{$\text{pH}$}$ וריכוז $\ce{CO2}$ משפיע על קישור החמצן בהמוגלובין.
השפעת $\text{pH}$
- ככל שה-$\text{pH}$ נמוך יותר, העקומה זזה ימינה (אפיניות נמוכה יותר)
- בריאות: $\text{pH}$ 7.6 - אפיניות גבוהה לחמצן
- ברקמות: $\text{pH}$ 7.2 - אפיניות נמוכה, שחרור חמצן
השפעת $\ce{CO2}$
- ריכוז $\ce{CO2}$ נמוך בריאות
- ריכוז $\ce{CO2}$ גבוה ברקמות
- $\ce{CO2}$ יוצר יון ביקרבונט ($\ce{HCO3-}$) שמוריד $\text{pH}$, מה שכאמור מפחית את האפיניות לחמצן
- השילוב של $\text{pH}$ נמוך + $\ce{CO2}$ גבוה גורם לשחרור מקסימלי של חמצן ברקמות
להבנתי, אפיניות נמוכה גוררת העדפה לקונפורמציית T, מה שמסייע בשחרור חמצן ברקמות.
2. 2,3-ביפוספוגליצרט (BPG)
תפקיד ה-BPG
- מולקולה מטבולית בריכוז של ~5 מילימולר בדם
- נקשרת בין 4 תת-היחידות (לא באתר קישור החמצן)
- נועלת את ההמוגלובין ב-$\text{T State}$
- ב-$\text{R State}$ הכיס נסגר ו-BPG לא יכול להיקשר
התאמה לגובה
- בגובה רב (מעל 4,500 מטר) הגוף מייצר יותר BPG
- זה גורם ליותר מולקולות המוגלובין להישאר ב-$\text{T State}$
- התוצאה: שחרור יעיל יותר של חמצן ברקמות למרות המחסור בחמצן באוויר
- פיצוי של 7-8% נוספים בשחרור חמצן
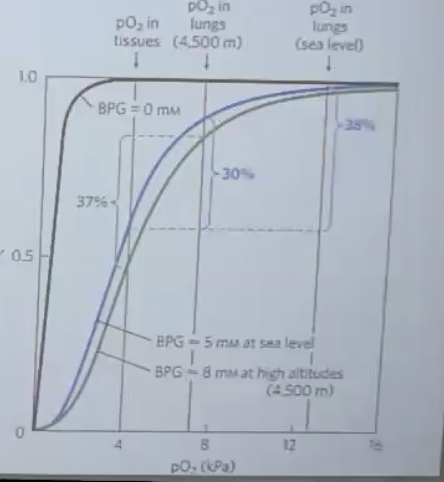
- העקומה הולכת ימינה ← יותר חמצן משתחרר
- יותר BPG ← יותר $\text{T State}$ ← אפיניות נמוכה יותר לחמצן
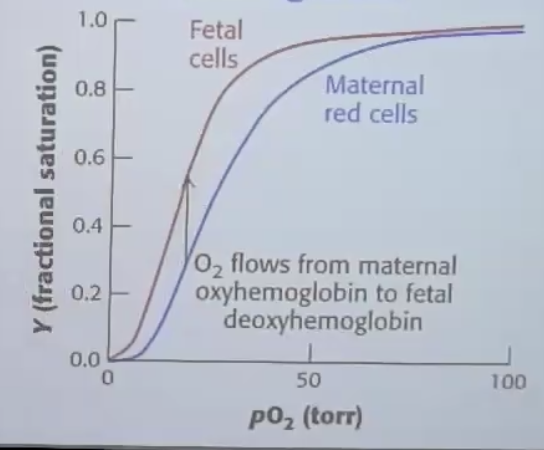
3. המוגלובין עוברי
- להמוגלובין העוברי אפיניות גבוהה יותר מהמוגלובין של האם
- מאפשר מעבר חמצן מהאם לעובר דרך השליה
- העקומה של העובר שמאלית יותר (אפיניות גבוהה)
- נובע מהסביבה השונה בשליה ($\text{pH}$ שונה, תנאים אחרים)
אנמיה חרמשית - דוגמה למוטציה בהמוגלובין
המוטציה
- מוטציה בחומצה אמינית מספר 6 בשרשרת β
- החלפה: גלוטמט ($\ce{E}$) ← ולין ($\ce{V}$)
- גלוטמט: חומצה אמינית טעונה שלילית
- ולין: חומצה אמינית הידרופובית
המנגנון הפתולוגי
- הוולין נכנס לכיס הידרופובי (פנילאלנין + לאוצין) בטטרמר שכן
- נוצרת אינטראקציה בין טטרמרים
- נוצרים פיברילים (סיבים) ארוכים של המוגלובין
- הפיברילים דוחקים את דפנות התא
- תאי הדם מקבלים צורה מעוותת (חרמש)
התוצאות
- התאים אינם פונקציונליים - לא יכולים לעבור בין T ל-R
- אנמיה - חולשה ועייפות כרונית
- בעיות בהובלת חמצן
מקדם היל (Hill Coefficient)
הגדרה
שיטה לבחון האם קישור ליגנד-חלבון הוא קואופרטיבי
משוואת היל
\[\log\left[\frac{Y}{(1-Y)}\right] = n \cdot \log \left( p \ce{O2} \right) - n \cdot \log(P_{50})\]כאשר:
- $Y$ = חלק האתרים התפוסים
- $n$ = מקדם היל
- $P_{50}$ = לחץ חמצן ב-50% תפוסה
פירוש הערכים
- $n = 1$: אין קואופרטיביות (כמו מיוגלובין - שהרי רק אתר קישור אחד)
- $n > 1$: קואופרטיביות חיובית (כמו המוגלובין, $n = 2.8$)
- $n < 1$: קואופרטיביות שלילית (קישור גורם לשחרור)
החשיבות
- נותן ערך מספרי ברור לרמת הקואופרטיביות
- מאפשר השוואה בין חלבונים שונים
- עוזר לנתח נתונים ניסיוניים ״רועשים״
מבוא לקינטיקה אנזימטית
מהו אנזים?
- חלבון (או לעתים RNA - ריבוזים) עם פעילות קטליטית
- מכיל אתר פעיל
- מזרז ריאקציות ביוכימיות
מונחים בסיסיים
- אנזים (E): החלבון הקטליטי עם האתר הפעיל
- סובסטרט (S): המגיב בריאקציה
- תוצר (P): התוצר של הריאקציה
מחזור הקטליזה
- סובסטרט נקשר לאתר הפעיל
- מתרחשת ריאקציה כימית
- נוצר תוצר עם תכונות שונות
- התוצר משתחרר (אפיניות נמוכה)
- האנזים פנוי למחזור נוסף
למה צריך אנזימים?
- ריאקציות ביולוגיות רבות איטיות מאוד בלעדיהם
- דוגמה: המרת פירובט לאצטיל-CoA (לקראת מעגל קרבס)
- בלי אנזים פירובט דהידרוגנאז התהליך היה איטי מכדי לקיים חיים
עקרונות חשובים
- אנזימים לא קובעים אם ריאקציה תתרחש - רק מזרזים
- הריאקציה חייבת להיות תרמודינמית אפשרית (ΔG שלילי)
- האנזים מוריד את אנרגיית האקטיבציה
אנרגיית אקטיבציה
- ההפרש בין רמת האנרגיה של המגיבים לפיק המחסום האנרגטי
- אנזימים מורידים את גובה המחסום
- זה מאפשר ליותר מולקולות לעבור את המחסום ביחידת זמן
- התוצאה: האצה דרמטית של קצב הריאקציה (עד פי 10,000 ויותר)
דוגמה גרפית
- ללא אנזים: ריאקציה איטית, התקדמות ליניארית איטית
- עם אנזים: אותה ריאקציה מגיעה כמעט ל-100% תוצר תוך שניות