עיבוד והכוונה של חלבונים בתאים אוקריוטיים: מהסינתזה ליעד
פתיחה: האתגר הביולוגי של הארגון התאי
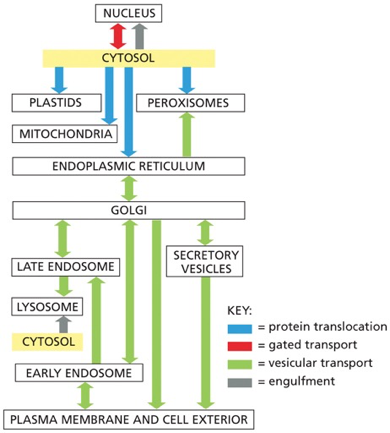
התא האוקריוטי מציב בפנינו אחד האתגרים המרתקים ביותר בביולוגיה: כיצד מערכת כה מורכבת, הכוללת עשרות אלפי חלבונים שונים, מצליחה לתפקד בצורה מסודרת ויעילה? התשובה טמונה בעיקרון המנחה של הקומפרטמנטליזציה (compartmentalization) - החלוקה של התא למדורים מתמחים, שבהם מתבצעים תהליכים ביוכימיים ספציפיים בסביבה מווסתת ומבוקרת.
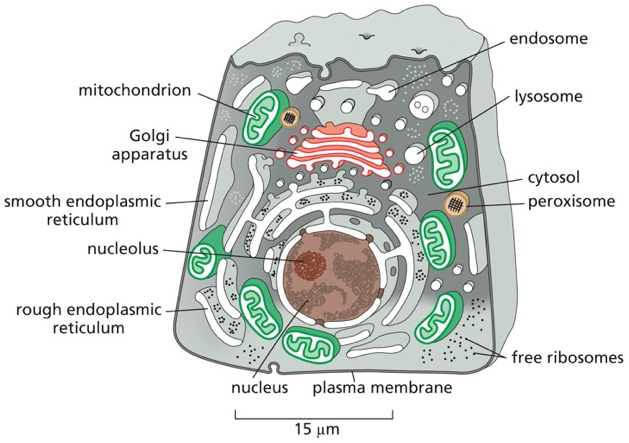
אולם החלוקה למדורים יוצרת בעיה לוגיסטית עצומה: כמעט כל החלבונים בתא מסונתזים במקום אחד - על גבי ריבוזומים בציטוסול, אך הם נדרשים לתפקד במדורים שונים ומרוחקים. כיצד חלבון “יודע” שהוא צריך להגיע לגרעין ולא למיטוכונדריה? איך חלבון המיועד להפרשה מוצא את דרכו דרך המבוך המורכב של הרשת האנדופלזמית והגולג׳י? ומה מונע מחלבונים להגיע למקומות הלא נכונים?
התשובה המרתקת היא שכל חלבון נושא עמו, מרגע היווצרותו, “כתובת מדויקת” המקודדת ברצף חומצות האמינו שלו. זהו רעיון מהפכני שפותח בשנות השבעים של המאה הקודמת, והוא עומד בבסיס הבנתנו המודרנית של ביולוגיה תאית.
פרק ראשון: תגליות פורצות דרך - מפלאדה לבלובל
המהפכה הטכנולוגית: מיקרוסקופיה אלקטרונית וטכניקות מעקב
ההתפתחות בהבנת מורכבותו של התא האוקריוטי החלה באמצע המאה העשרים, עם פיתוח שתי טכנולוגיות מהפכניות: המיקרוסקופיה האלקטרונית, שחשפה לראשונה את המבנה הפנימי המורכב של התא, והטכניקות הרדיואקטיביות שאפשרו מעקב אחר מולקולות בודדות בתא החי.
ג׳ורג׳ פלאדה, רופא רומני שהקדיש את חייו למחקר, היה הראשון להבין שהתמונות הסטטיות של המיקרוסקופ האלקטרוני מסתירות מציאות דינמית מורכבת. הוא פיתח את הגישה המהפכנית של שחזור תהליכים תאיים במבחנה, ובכך הניח את הבסיס לביולוגיה ניסויית מודרנית.

ניסוי הפולס-צ’ייס: חלון לעולם הדינמי של התא
הניסוי החשוב ביותר של פלאדה, הפולס-צ’ייס (pulse-chase), מהווה דוגמה קלאסית לאלגנטיות המחקר הביולוגי. העיקרון פשוט אך גאוני: תאים נחשפים לזמן קצר (פולס) לחומצות אמינו מסומנות רדיואקטיבית, כך שכל החלבונים שמסונתזים באותו פרק זמן מקבלים “תווית” רדיואקטיבית. לאחר מכן, חומצות האמינו הרדיואקטיביות מוחלפות בכמות עודפת של חומצות אמינו לא מסומנות (צ’ייס), כך שחלבונים חדשים שיסונתזו לא יהיו מסומנים.
הגאונות של השיטה טמונה ביכולת לעקוב אחרי המסלול של אותו חלבון בזמנים שונים. בתחילת הפולס, כל הסימון הרדיואקטיבי נמצא ברשת האנדופלזמית הגסה - שם מסונתזים חלבוני ההפרשה. עם הזמן, הסימון עובר למתקן הגולג׳י, משם לשלפוחיות עיכוי (condensing vesicles), ולבסוף לזימוגן גרנולס - השלפוחיות שמכילות את האנזימים הלא פעילים המיועדים להפרשה.
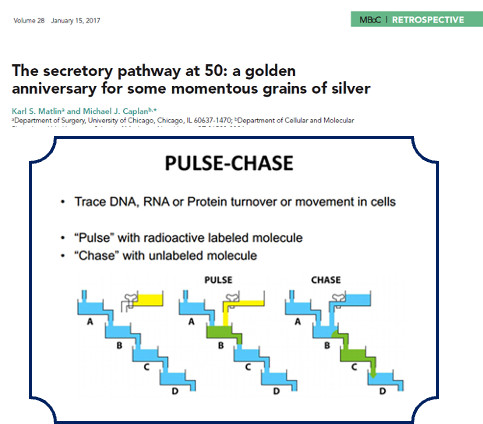
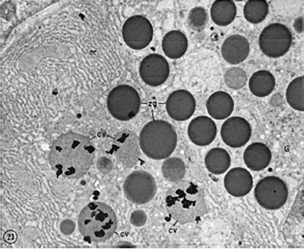
התגלית החשובה הייתה שזהו מסלול כיווני וסדור: חלבונים לא נודדים באקראי בתא, אלא עוקבים אחר מסלול קבוע ומוגדר מראש. יתרה מכך, החלבונים נשמרים בצורה לא פעילה (כזימוגנים) לאורך כל המסלול, ומופעלים רק כשמגיעים ליעדם הסופי - עיקרון שחוזר על עצמו פעמים רבות בביולוגיה.
היפותזת הסיגנל של בלובל: מהיפותזה למהפכה
גינטר בלובל, רופא גרמני שהפך לחוקר ביולוגיה, לקח את התגליות של פלאדה צעד נוסף קדימה. בשנת 1971, הוא הציע היפותזה נועזת שהייתה אמורה לשנות לחלוטין את הבנתנו של עולם החלבונים: “היפותזת הסיגנל”. לפי היפותזת הסיגנל, חלבונים לא מגיעים ליעדים הרצויים במקרה, אלא נושאים עמם רצפי הכוונה מובנים.

העיקרון המהפכני שבלובל הציע היה שהמידע הדרוש להכוונת חלבון ליעדו מקודד בתוך רצף חומצות האמינו של החלבון עצמו. בפשטות מדהימה: החלבון נושא עמו את כתובתו.
המודל של בלובל תיאר תהליך דינמי: כאשר חלבון המיועד להפרשה מתחיל להיווצר על ריבוזום חופשי בציטוסול, רצף הסיגנל שלו - הנמצא ב-N-terminus - מזוהה על ידי “גורם קישור” עוד כשהחלבון נמצא בתהליך סינתזה. זיהוי זה גורם לצימוד הריבוזום לממברנה של הרשת האנדופלזמית, והחלבון הגדל נדחף דרך הממברנה אל תוך הלומן.
התובנה החדה של בלובל הייתה שרצף הסיגנל נחתך במהלך התהליך. חיתוך זה קריטי לשני מטרות: ראשית, הוא מעניק כיווניות לתהליך - ברגע שנחתך הסיגנל, החלבון לא יכול לחזור לציטוסול. שנית, הסרת הסיגנל מאפשרת לחלבון להשיג את הצורה הפעילה שלו.
פרק שני: האינסולין כדוגמה קלאסית
מסע האינסולין: מגן להורמון פעיל
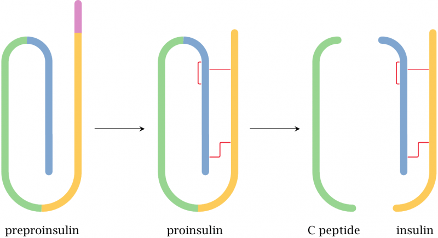
האינסולין מהווה דוגמה מושלמת למורכבות תהליכי העיבוד והכוונה של חלבונים. ההורמון הפעיל הוא מולקולה קטנה יחסית, המורכבת משתי שרשראות פוליפפטידיות קצרות (A ו-B) המחוברות בגשרים דיסולפידיים. אולם המסע שלו מהגן להורמון הפעיל הוא מורכב ורב שלבי.
תהליך הסינתזה מתחיל בתאי בטא של האיים בלבלב, שם מסונתז תחילה פרפרו-אינסולין - מולקולה ארוכה יותר המכילה שלושה מקטעים עיקריים:
- רצף הסיגנל (Signal peptide) - ב-N-terminus, המכוון את החלבון לרשת האנדופלזמית
- שרשרת B - שתהפוך לאחד משני החלקים של האינסולין הבשל
- C-peptide - מקטע מקשר
- שרשרת A - החלק השני של האינסולין הבשל
כאשר תהליך התרגום מתחיל, רצף הסיגנל מופיע ראשון מהריבוזום ומזוהה מיד על ידי מערכת הזיהוי. הריבוזום מוצמד לרשת האנדופלזמית, והחלבון הגדל נדחף פנימה ללומן. שם, בסביבה החומצית של הרשת האנדופלזמית, נוצרים הגשרים הדיסולפידיים הקריטיים לפעילות הביולוגית.
הסביבה החומצית של לומן הרשת האנדופלזמית קריטית ליצירת הגשרים הדיסולפידיים. בציטוסול, הסביבה חזקה ומונעת יצירת גשרים כאלה, אך בתוך הרשת האנדופלזמית הסביבה מאפשרת ואף מעודדת תהליך זה. זאת דוגמה יפה לחשיבות הקומפרטמנטליזציה - אותו תהליך שיכול להזיק בסביבה אחת, חיוני בסביבה אחרת.
עיבוד רב שלבי: מהכוונה להפעלה
לאחר יצירת הגשרים הדיסולפידיים, הפרפרו-אינסולין עובר עיבוד נוסף. רצף הסיגנל נחתך על ידי אנזים ייעודי (signal peptidase), והמולקולה הופכת לפרו-אינסולין. המולקולה ממשיכה במסלול ההפרשה - עוברת למתקן הגולג׳י, משם לשלפוחיות הפרשה. רק בשלב המאוחר, בתוך שלפוחיות ההפרשה, נחתך גם C-peptide, והאינסולין הופך לפעיל.
התזמון של החיתוכים אינו מקרי. האינסולין הפעיל הוא הורמון עוצמתי, שיכול לגרום לנזק רב אם ישוחרר בזמן הלא נכון או במקום הלא נכון. על ידי שמירה על המולקולה בצורה לא פעילה עד הרגע האחרון, התא מבטיח ששיחרור ההורמון יהיה מבוקר ומדויק.
פרק שלישי: המערכת הממברנלית כרשת תחבורה
הרשת האנדופלזמית: מפעל הייצור התאי
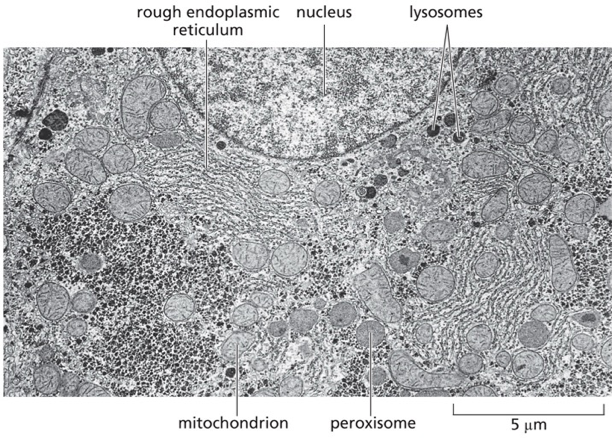
הרשת האנדופלזמית (Endoplasmic reticulum - ER) מהווה את המדור הגדול ביותר במערכת הממברנות הפנימיות של התא, ותפקידה הולך הרבה מעבר לסינתזת חלבונים. היא משמשת כמפעל ייצור מורכב שמייצר ומעבד מגוון עצום של מוצרים ביולוגיים: חלבונים, ליפידים, פוספוליפידים, סטרואידים ועוד.
אנדו-פלזמית = בתוך הפלזמה
הרשת האנדופלזמית מחולקת לשני אזורים עיקריים בעלי מאפיינים ותפקידים שונים:
- הרשת האנדופלזמית הגסה (Rough ER - rER): מאופיינת בריבוזומים הצמודים לצד הציטופלזמי של הממברנה. כאן מסונתזים חלבונים המיועדים להפרשה, לממברנות, או למדורים אורגנליים ספציפיים. הריבוזומים אינם צמודים באופן קבוע - הם נצמדים בתחילת סינתזת חלבון עם רצף סיגנל ומשתחררים בסיום התהליך.
- הרשת האנדופלזמית החלקה (Smooth ER - sER): נטולת ריבוזומים ומתמחה בסינתזה של ליפידים, פוספוליפידים וסטרואידים. באיברים מסוימים, כמו הכבד, היא מתמחה גם בניקוי רעלים וחילוף חומרים של תרופות.
הדינמיות המורכבת של המערכת
בניגוד לתמונה הסטטית הנוצרת מתצלומי מיקרוסקופ, הרשת האנדופלזמית היא מערכת דינמית ביותר. היא נמצאת במצב מתמיד של שינוי צורה, הארכה, התכווצות וחלוקה. תנועות אלו מתואמות על ידי חלבוני מנוע הפועלים על גבי מערכת הציטוסקלטון, בעיקר מיקרוטובולים.
הדינמיות הזאת לא אקראית, אלא מווסתת בקפידה על ידי הצרכים המשתנים של התא. כאשר התא זקוק לייצור מוגבר של חלבוני הפרשה - למשל, כתגובה לסיגנל הורמונלי - נפח הרשת האנדופלזמית הגסה יכול לגדול במהירות. לעומת זאת, כאשר נדרשת סינתזה מוגברת של ממברנות או ליפידים - למשל, לקראת חלוקת תא - הרשת האנדופלזמית החלקה מתרחבת.
מנגנון הזיהוי והצימוד
המנגנון שבאמצעותו ריבוזומים מזהים שהם צריכים להיצמד לרשת האנדופלזמית מורכב ומפותח. התהליך מתחיל כאשר רצף הסיגנל של החלבון הגדל מתחיל להופיע מהריבוזום. רצף הסיגנל מזוהה מיד על ידי חלקיק זיהוי הסיגנל (Signal Recognition Particle - SRP), קומפלקס המורכב מ-RNA ומחלבונים.
ה-SRP קושר את רצף הסיגנל ועוצר זמנית את תהליך התרגום. זהו מנגנון הגנה חשוב - הוא מונע מהחלבון להמשיך להיווצר בציטוסול ולהתקפל שם בצורה שעלולה להיות שגויה. במקום זאת, כל הקומפלקס (ריבוזום + mRNA + SRP + החלבון הגדל) נע אל הרשת האנדופלזמית.
ברשת האנדופלזמית ממתין רצפטור SRP (SRP receptor), חלבון אינטגרלי הממברנה שמזהה את ה-SRP ומאפשר לריבוזום להצמד לממברנה. במקביל, נפתחת תעלה מיוחדת בממברנה (Translocon) שמאפשרת לחלבון הגדל לעבור דרכה אל תוך לומן הרשת האנדופלזמית.
פרק רביעי: עיבוד ובקרת איכות ברשת האנדופלזמית
הסביבה הייחודית של הלומן
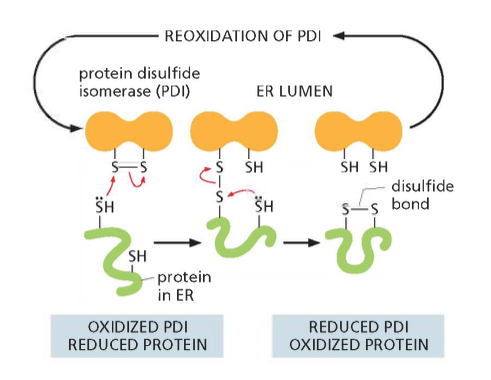
לומן הרשת האנדופלזמית מהווה סביבה ייחודית המותאמת במיוחד לעיבוד חלבונים. בניגוד לציטוסול, שבו שורר מצב מחזר, הלומן מתאפיין בסביבה חומצית. סביבה חומצית קריטית ליצירת גשרים דיסולפידיים - קשרים קוולנטיים בין קבוצות סולפיד של חומצות אמינו מסוג ציסטין.
הגשרים הדיסולפידיים ממלאים תפקיד מכריע ביציבות ובפונקציה של חלבונים רבים. הם מייצבים את המבנה התלת-ממדי של החלבון ומונעים ממנו להתפרק או לאבד את פעילותו. תהליך יצירתם צריך להיות מבוקר ומדויק - גשרים שנוצרים בין הציסטינים הלא נכונים יכולים לגרום לחלבון להתקפל באופן שגוי ולאבד את פעילותו.
מערכת השאפרונים והאנזימים המתקנים
בתוך לומן הרשת האנדופלזמית פועלת מערכת מתוחכמת של חלבוני עזר, הידועים בשם שאפרונים (Chaperones).
שאפרונים מסייעים לחלבונים חדשים להתקפל למבנה המרחבי התקין, מונעים הצטברות של קיפולים שגויים, ומזהים חלבונים שלא התקפלו כראוי.
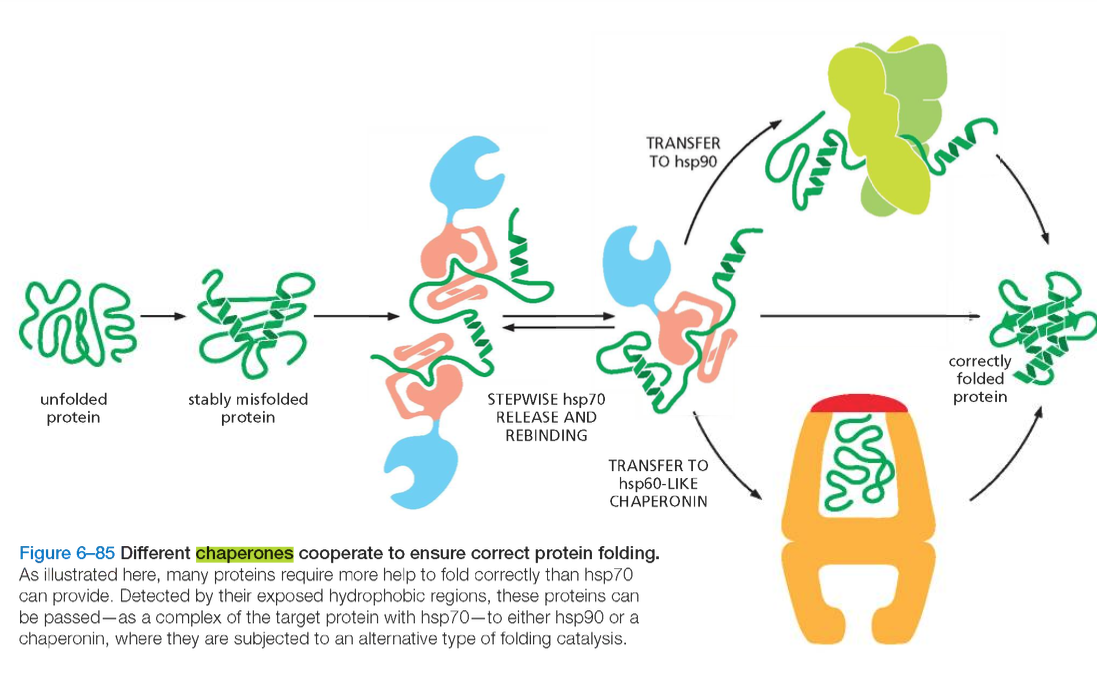
השאפרון המרכזי ברשת האנדופלזמית הוא BiP (Binding Immunoglobulin Protein), המשתייך למשפחת חלבוני ה-Hsp70.
BiP נקשר לחלבונים שלא התקפלו כראוי, ומסייע להם להגיע למבנה הפעיל התקין. כאשר חלבון ממשיך להיכשל בתהליך הקיפול, BiP שומר על הקשר אליו ומונע את מעברו לשלב הבא במסלול ההפרשה.
בנוסף לשאפרונים, פועלים בלומן גם אנזימים המתמחים בבקרת איכות ועיבוד מבני של חלבונים:
-
Protein Disulfide Isomerase (PDI) – אנזים המזרז את יצירת הגשרים הדיסולפידיים (S–S) בין שיירי ציסטאין, ומוודא שהם נוצרים בין זוגות תקינים. במקרים של קיפול שגוי, הוא מסוגל גם לשבור גשרים לא תקניים ולאפשר יצירתם מחדש.
-
Peptidyl-prolyl Isomerase – אנזים שמזרז איזומריזציה בין קונפורמציות cis/trans של קשרי פפטיד סביב שיירי פרולין, תהליך קריטי לקיפול חלבונים מסוימים שבהם פרולין יוצר עיכוב מבני.
תגובה לחלבונים לא מקופלים (Unfolded Protein Response)
כאשר כמות החלבונים הלא מקופלים ברשת האנדופלזמית עולה מעל רמה מסוימת - למשל, בתנאי לחץ או מחלה - התא מפעיל מנגנון הגנה מתוחכם הנקרא תגובת הלחץ הלא מקופל (UPR).
מנגנון UPR כולל שלושה מסלולי סיגנל עיקריים שמטרתם להתמודד עם העומס:
- הפחתת סינתזת חלבונים חדשים - כדי להפחית את העומס על המערכת
- הגברת ייצור שאפרונים ואנזימי עיבוד - כדי לשפר את יכולת העיבוד
- הפעלת מסלולי הרס חלבונים פגומים - כדי לפנות חלבונים שלא ניתן לתקן
אם המנגנונים הללו אינם מצליחים להתמודד עם הבעיה, התא עלול להיכנס לתוכנית מוות מתוכנת (אפופטוזיס) כדי למנוע נזק לרקמה שלמה.
פרק חמישי: מסלול ההפרשה - מהרשת האנדופלזמית לעולם החיצון
המעבר למתקן הגולג׳י
חלבונים שהושלם עיבודם בהצלחה ברשת האנדופלזמית אינם נשארים שם. הם נארזים בשלפוחיות הובלה מיוחדות ונשלחים ליעד הבא במסלול - מתקן הגולג׳י. תהליך זה מדויק ביותר ומבוסס על מיון וברירה קפדניים.
המנגנון פועל באמצעות זיהוי של “תוויות יצוא” על החלבונים. חלבונים שעברו קיפול נכון וכל התהליכים הנדרשים מקבלים תווית שמסמנת אותם כמוכנים ליצוא. התווית הזו מזוהה על ידי חלבונים מיוחדים שמארזים את החלבונים בשלפוחיות הובלה.
שלפוחיות ההובלה אינן סתם “מכולות” להעברת חומרים. הן מערכות הובלה מתוחכמות הכוללות:
- מנגנוני כיוון: חלבונים על פני השלפוחית שמזהים את היעד הנכון
- מנגנוני איחוי: מערכות שמבטיחות ששלפוחית תתמזג רק עם המדור הנכון
- מנגנוני בקרה: מערכות שמונעות איחוי שגוי או מוקדם מדי
מתקן הגולג׳י: עיבוד מתקדם ומיון סופי
מתקן הגולג׳י מהווה “תחנת העיבוד המתקדם” במסלול ההפרשה. בניגוד לרשת האנדופלזמית, שעוסקת בעיקר בקיפול בסיסי ויצירת גשרים דיסולפידיים, הגולג׳י מתמחה בעיבודים כימיים מורכבים יותר.
המתקן מורכב ממספר תתי-מדורים הארגונים בסדר מדויק:
- ה-Cis Golgi: הצד המקבל, הקרוב לרשת האנדופלזמית
- ה-Medial Golgi: האזור האמצעי
- ה-Trans Golgi: הצד המשחרר, שממנו יוצאים החלבונים המעובדים
כל אזור מתמחה בסוגי עיבוד שונים:
גליקוזילציה: הוספת קבוצות סוכר לחלבונים. תהליך זה קריטי לפונקציה של חלבונים רבים ומשפיע על יציבותם, כיוונם ופעילותם הביולוגית.
פוספורילציה: הוספת קבוצות פוספט שיכולות לשנות את פעילות החלבון או לשמש כסיגנל להכוונה נוספת.
פרוטיאוליזה מוגבלת: חיתוך מדויק של חלבונים להפעלתם או לשינוי פונקציה.
הקבלה הסופית: מיון ליעדים שונים
אחד התפקידים החשובים ביותר של הגולג׳י הוא המיון הסופי של חלבונים ליעדיהם השונים. מה-Trans Golgi יוצאים חלבונים לכמה יעדים אפשריים:
- הפרשה קונסטיטוטיבית: חלבונים שמופרשים באופן רציף ללא צורך בסיגנל חיצוני
- הפרשה מווסתת: חלבונים שנשמרים בשלפוחיות מיוחדות ומופרשים רק בתגובה לסיגנל ספציפי
- ליזוזומים: אנזימים פרוטאוליטיים המיועדים לפירוק חומרים
- ממברנת התא: חלבונים שיתמזגו עם הממברנה ויפעלו שם
תהליך המיון מבוסס על זיהוי מדויק של רצפי הכוונה ספציפיים לכל יעד. טעויות במיון יכולות להוביל למחלות חמורות, כפי שרואים במחלות ליזוזומליות, שבהן אנזימים נשלחים למקום הלא נכון.
פרק שישי: המערכת הגרעינית - שער המידע התאי
מבנה מעטפת הגרעין: מעבר בין עולמות
הגרעין מהווה את “מרכז הפיקוד” של התא האוקריוטי, המכיל את כל המידע הגנטי ומרבית המנגנונים להעתקתו ועיבודו. הפרדת הגרעין מהציטופלזמה מאפשרת שליטה דקיקה על תהליכי התעתקה, עיבוד RNA, וויסות ביטוי גנים. אולם הפרדה זו יוצרת אתגר לוגיסטי עצום: כיצד מולקולות נדרשות חודרות פנימה, וכיצד תוצרים מוכנים יוצאים החוצה?
מעטפת הגרעין שונה מיסודה ממדורים אורגנליים אחרים. היא מורכבת משתי ממברנות נפרדות:
- הממברנה החיצונית: המשך ישיר של הרשת האנדופלזמית, נושאת ריבוזומים ומחוברת ללומן הרשת האנדופלזמית
- הממברנה הפנימית: ממברנה ייחודית הצמודה לכרומטין ומעוגנת על ידי חלבוני למין
בין שתי הממברנות קיים לומן (perinuclear space) המהווה המשך של לומן הרשת האנדופלזמית. מבנה זה מאפשר תקשורת ישירה בין הגרעין למערכת הממברנות הפנימיות, אך שומר על הפרדה מוחלטת בין התוכן הגרעיני לציטופלזמה.
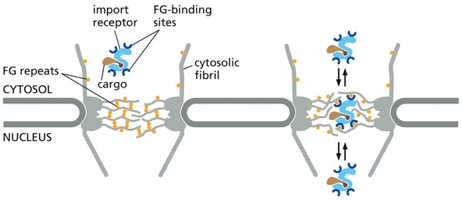
נקבוביות הגרעין: שערים מולקולריים מורכבים (Nuclear Pore Complexes - NPCs)
המעבר בין הגרעין לציטופלזמה מתבצע באמצעות מבנים מורכבים ומפותחים שנקראים נקבוביות גרעין (Nuclear Pore Complexes - NPCs). כל נקבובית היא מבנה ענק מבחינה מולקולרית, המורכב מכ-800-700 שרשראות פוליפפטידיות שונות, שמאורגנות בסימטריה של שמונה סביב תעלה מרכזית.
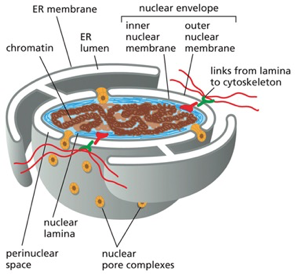
נקבוביות הגרעין כוללות מספר רכיבים מרכזיים:
- הגוף המרכזי: הממוקם בתוך הממברנות ויוצר את התעלה הבסיסית
- הסל הגרעיני (Nuclear Basket): מבנה דמוי סל הבולט אל תוך הגרעין
- הסיבים הציטופלזמיים: זרועות ארוכות הבולטות אל הציטופלזמה
למרות הרושם שהתעלה פתוחה, קיים בה מחסום בררני (permeability barrier) שמונע מעבר חופשי של מאקרומולקולות. מחסום זה מורכב מחלבונים המכילים רצפים חוזרים עשירים בפנילאלנין וגליצין (FG repeats), היוצרים מעין “רשת מולקולרית” שמאפשרת מעבר בררני.
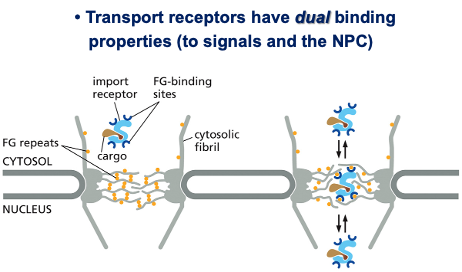
מנגנוני הטרנספורט הגרעיני
הטרנספורט דרך נקבוביות הגרעין הוא תהליך פעיל הדורש אנרגיה וחלבוני עזר מיוחדים. המערכת מבוססת על עיקרון של רצפטורי הובלה מחזוריים (shuttling transport receptors), הידועים כאימפורטינים (לכניסה) ואקספורטינים (ליציאה).
רצפטורי ההובלה המרכזיים שונים בתכלית מרצפטורי ממברנה רגילים - הם לא עוגנים למקום אחד, אלא נעים הלוך ושוב בין הגרעין לציטופלזמה. המחזור הבסיסי כולל מספר שלבים:
- זיהוי המטען: הרצפטור מזהה ונקשר למטען שלו (קארגו) בציטופלזמה
- מעבר דרך הנקבובית: הקומפלקס עובר דרך המחסום הבררני
- שחרור בגרעין: המטען משתחרר בתוך הגרעין
- חזרה לציטופלזמה: הרצפטור חוזר לציטופלזמה למחזור חדש
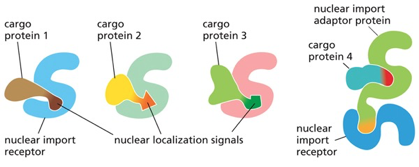
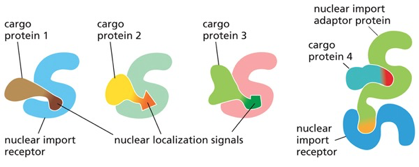
הרצף NLS הקלאסי ומנגנון פעולתו
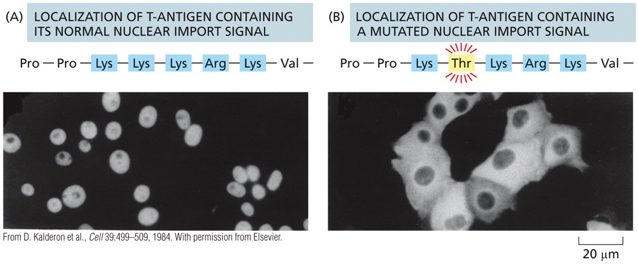
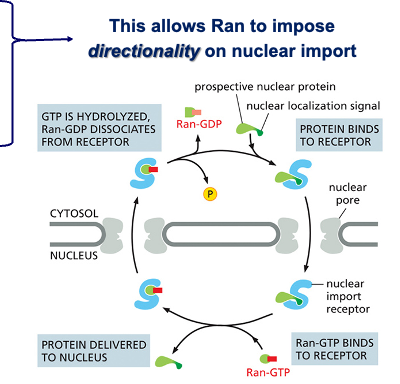
הכוונת חלבונים לגרעין מבוססת על זיהוי רצפי הכוונה גרעיניים (Nuclear Localization Signals - NLS). הרצף הקלאסי, שהתגלה לראשונה בחלבון הויראלי Large T Antigen של וירוס SV40, מהווה דוגמה מושלמת לעוצמה של רצפי הכוונה.
הרצף: ליזין-ליזין-ליזין-ארגינין-ליזין, המורכב מחמש חומצות אמינו בעלות מטען חיובי, מספיק להכוונת כל חלבון לגרעין. המחקר שהוביל לגילוי זה השתמש בהנדסה גנטית לשינוי חומצה אמינית אחת - החלפת ליזין אחד בתריאונין - מספיק כדי לבטל לחלוטין את יכולת ההכוונה לגרעין.
המנגנון פועל באמצעות אימפורטין-α ואימפורטין-β:
- אימפורטין-α: מזהה ונקשר ישירות לרצף ה-NLS על החלבון המיועד
- אימפורטין-β: נקשר לאימפורטין-α ומתווך את המעבר הפיזי דרך נקבובית הגרעין
לאחר הכניסה לגרעין, החלבון Ran-GTP גורם לפירוק הקומפלקס ולשחרור המטען, ואימפורטין-β חוזר לציטופלזמה.
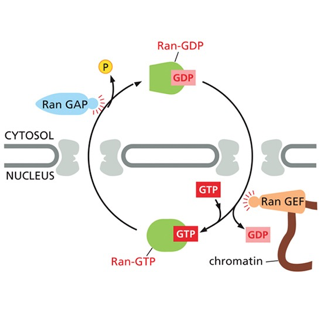
Ran = Ras-related nuclear protein
מורכבות המערכת: מסלולים מרובים ווויסות דק
המערכת האמיתית הרבה יותר מורכבת מהתיאור הבסיסי. קיימים עשרות מסלולי כניסה ויציאה שונים, כל אחד מותאם לסוג מטען ספציפי:
- מסלולי כניסה שונים: לחלבונים שונים יש רצפי NLS שונים, המזוהים על ידי אימפורטינים ספציפיים
- מסלולי יציאה: חלבונים עם רצפי יצוא גרעיניים (Nuclear Export Signals - NES) מועברים החוצה בתיווך אקספורטינים
- מטענים מורכבים: תת-יחידות ריבוזום, קומפלקסי RNA-חלבון, ואף וירוסים שלמים עוברים במסלולים מיוחדים
המורכבות הזו מאפשרת לתא שליטה עדינה בהרכב הגרעיני. חלבונים עם גם רצף כניסה וגם רצף יציאה יכולים להיות מווסתים באמצעות הסתרה או חשיפה של אחד הרצפים, מה שמאפשר תגובה מהירה לשינויים בתנאי התא.
דוגמה קלאסית היא ויסות גורמי תעתוק בתגובה לסיגנלים הורמונליים. כאשר מגיע אינסולין לתא, הוא מפעיל רצף אירועים שמוביל לכניסה של גורמי תעתוק מסוימים לגרעין, שם הם מפעילים ביטוי של גנים מסוימים. כאשר הסיגנל נעלם, אותם גורמי תעתוק עלולים להיות מועברים חזרה לציטופלזמה או אף לעבור פירוק.
פרק שביעי: ויסות, בקרת איכות והשלכות פתולוגיות
מערכות בקרת איכות רב שלביות
המערכת המורכבת של הכוונת חלבונים חייבת לכלול מנגנוני בקרת איכות מתוחכמים. שגיאות בהכוונה יכולות להיות קטלניות - אנזים פרוטאוליטי שמגיע לגרעין במקום לליזוזום יכול להרוס את ה-DNA, וחלבון ממברנה שמגיע לציטוסול עלול ליצור צבירים רעילים.
בכל שלב במסלול קיימים מנגנוני בקרה:
- ברמת הסינתזה: מערכת SRP מוודאת שחלבונים עם רצף סיגנל יגיעו לרשת האנדופלזמית ולא יישארו בציטוסול
- ברמת הקיפול: שאפרונים ומערכת UPR מוודאים שרק חלבונים מקופלים נכון ימשיכו במסלול
- ברמת ההכוונה: רצפטורי הובלה בררניים מוודאים שחלבונים יגיעו רק ליעדים הנכונים
- ברמת היעד: מערכות זיהוי ביעד מוודאות שרק חלבונים מתאימים יישארו במדור
כאשר מנגנוני הבקרה מזהים שגיאה, נכנסות פעולה מערכות “חירום”:
- מערכת האוביקוויטין-פרוטאזום: מסמנת חלבונים פגומים להרס
- אוטופגיה: מפרקת מדורים שלמים שנפגעו
- אפופטוזיס: במקרים קיצוניים, התא נכנס למוות מתוכנת כדי להגן על הרקמה
השלכות רפואיות של הפרעות בהכוונה
הפרעות במערכת הכוונת החלבונים עומדות בבסיס מחלות רבות ומגוונות. כמה דוגמאות בולטות:
מוקופוליסכרידוזיס: מחלות הנגרמות מהפרעה בהכוונת אנזימים לליזוזומים. האנזימים נשלחים בטעות החוצה מהתא במקום לליזוזומים, מה שגורם להצטברות של חומרי פסולת ברקמות.
מחלות פרובות (Protein folding diseases): כמו אלצהיימר, פרקינסון והנטינגטון, הקשורות להפרעות בקיפול ובהכוונה של חלבונים במערכת העצבים.
מחלות כבד: חלק ממחלות הכבד קשורות להפרעות בסינתזה ובהפרשה של חלבוני פלזמה.
סוכרת: חלק מצורות הסוכרת נגרמות מהפרעות בעיבוד או בהפרשה של אינסולין.
הבנה מולקולרית לטיפולים חדשים
ההבנה המעמיקה של מנגנוני הכוונת החלבונים פותחת דרכים חדשות לטיפול:
- טיפולי החלפה אנזימטית: הזרקה של אנזימים מעובדים שיכולים להגיע ליעדים הנכונים בתאים חולים
- תרופות שאפרון: מולקולות קטנות שמסייעות לחלבונים מוטנטים להתקפל נכון
- טיפול גני: הכנסה של גנים תקינים שיפצו על הפרעות גנטיות במערכת ההכוונה
פרק שמיני: היבטים אבולוציוניים ואנרגטיים
המחיר האנרגטי של הקומפרטמנטליזציה
המערכת המורכבת של הכוונת חלבונים דורשת השקעה אנרגטית עצומה. השאלה הטבעית היא: מדוע התפתחה מערכת כה יקרה אנרגטית, כאשר תאים פרוקריוטיים מתפקדים ללא הפרדה מדורית מורכבת?
ההשקעה האנרגטית כוללת:
- סינתזה של חלבוני עזר: אלפי מולקולות שונות המשרתות את מערכת ההכוונה
- תחזוקת גרדיאנטים: שמירה על הבדלי הרכב בין מדורים
- תהליכי הובלה פעילים: מעבר של מולקולות נגד גרדיאנטי ריכוז
- מנגנוני בקרת איכות: מערכות מורכבות לזיהוי ותיקון שגיאות
היתרונות האבולוציוניים
למרות המחיר הגבוה, הקומפרטמנטליזציה מעניקה יתרונות אבולוציוניים משמעותיים:
- התמחות תפקודית: כל מדור יכול להתפתח להתמחות בתהליכים ספציפיים
- יעילות מטבולית: ריכוז אנזימים במקום הנכון מגביר יעילות
- גמישות ווויסות: אפשרות לווסת תהליכים בצורה עדינה ומורכבת
- הפרדת תהליכים מתנגדים: תהליכים שיכולים להפריע זה לזה מופרדים מרחבית
היתרונות הללו הכרחיים לפיתוח של יצורים רב-תאיים מורכבים, עם רקמות מתמחות ומערכות איברים מתוחכמות.
השוואה עם מערכות פרוקריוטיות
תאים פרוקריוטיים אמנם נטולי קומפרטמנטליזציה מורכבת, אך הם מכילים את האבני הבניין הבסיסיות של מערכת ההכוונה. רצפי סיגנל קיימים גם בחיידקים, בעיקר להכוונת חלבונים לממברנה או להפרשה החוצה. האבולוציה של מערכת מורכבת יותר איפשרה את הקפיצה לרמת מורכבות של תאים אוקריוטיים.
מסקנות: מערכת מורכבת עם עקרונות פשוטים
המערכת של עיבוד והכוונת חלבונים, למרות מורכבותה הרבה, מבוססת על עקרונות פשוטים ואלגנטיים:
- מידע מקודד ברצף: כל חלבון נושא את המידע הדרוש להכוונתו ברצף חומצות האמינו שלו
- זיהוי ספציפי: מערכות זיהוי מולקולריות מבטיחות שכל חלבון יגיע ליעדו הנכון
- עיבוד הדרגתי: תהליכים מורכבים מתרחשים בשלבים, המאפשרים בקרה ותיקון
- בקרת איכות רב שלבית: כל שלב כולל מנגנוני בקרה למניעת שגיאות
- גמישות ווויסות: המערכת מאפשרת התאמה לשינויים בתנאי התא
ההבנה הזו חיונית לא רק להכרת הביולוגיה הבסיסית, אלא גם לפיתוח טיפולים רפואיים, כלי הנדסה גנטית, ויישומים ביוטכנולוגיים. המורכבות הזו מייצגת את היופי של המערכות הביולוגיות - פתרונות אלגנטיים לבעיות הנדסיות מורכבות, שמאפשרים חיים מורכבים ומגוונים על פני כדור הארץ.
בסופו של דבר, מערכת הכוונת החלבונים מדגימה כיצד מידע גנטי פשוט מתורגם לארגון מרחבי וזמני מורכב, המאפשר לתא לתפקד כיחידה מתוחכמת וחכמה. זהו אחד מביטויי הגאונות של האבולוציה הביולוגיה - יצירת מורכבות עצומה מרכיבים פשוטים, באמצעות עקרונות ברורים ומובנים.
דור פסקל