היברידיזציה ומבנה מולקולרי
אנחנו נסתכל עכשיו מה שנקרא valence bond method. אנחנו נסתכל על כל אלקטרון וננסה להבין את הקישור.
\( \text{H}_2\text{S} \) - דוגמה לקישור קובלנטי בלי היברידיזציה (להבנתי)
הדוגמה הכי פשוטה בוא נסתכל על המולקולה \( \text{H}_2\text{S} \). זה מולקולה שמתקיים בה קישור. למה אני בוחר אותה מיד אתם תראו.מולקולה שנקראת \( \text{H}_2\text{S} \). אם אתם תלכו ותעשו את האורביטלים של מימן, כמה אורביטלים יש לו? אם אתה מסתכל על מימן יש לו \( 1s \), אלקטרון 1, נכון? מסכימים? זה מימן. כל מימן כזה מגיע עם 1 אלקטרון ברמת \( s \) ואורביטל \( s \). אתם זוכרים איך הוא נראה? עגול. לכל מימן יש אורביטל \( s \) עגול. זה האורביטל של מימן.
סידור האלקטרונים של הגופרית: \[ \begin{array}{cccccccc} \text{Sulfur} & : & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & {\boxed{\uparrow\downarrow} \boxed{\uparrow\downarrow} \boxed{\uparrow\downarrow}} & \boxed{\uparrow\downarrow} & {\boxed{\uparrow\downarrow} \boxed{\uparrow} \boxed{\uparrow} } \\ & & 1s & 2s & {2p} & 3s & {3p} \\ \end{array} \] אלקטרוני הקשר: \[ \begin{array}{ccc} \text{S [Ne]} & \boxed{\uparrow\downarrow} & {\boxed{\uparrow\downarrow} \boxed{\uparrow} \boxed{\uparrow} } \\ & 3s & 3p & \\ \end{array} \] \[ \begin{array}{cc} \text{H} & \boxed{\uparrow} \\ & 1s \\ \end{array} \ \ \ \ \begin{array}{cc} \text{H} & \boxed{\uparrow} \\ & 1s \\ \end{array} \]
אם תלכו לגופרית ותנסו לסדר אותה, אז גופרית היא כמו ניאון. ואז יש לך \( 3s \) שני אלקטרונים ו-\( 3p \) יש לך צמד אלקטרונים משובץ ושני אלקטרונים לא משובצים. אז בעצם יש לו שני אורביטלי שהוא יכול לבצע קישור. אז אם אני אסתכל מנקודת המבט של אורביטלים אז אני אגיד רגע, בעצם המולקולה הזאת הקישור עזוב אותי מבני לואיס, הקישור נעשה ככה בין אורביטלי \( s \). יש לי כאן פונקציות גל \( s \), היא תחפוף עם פונקציות הגל החיובית \( p \) ואני אצור קשר. כי אמרנו שקשרים זה פונקציות גל שחופפות. אם הפונקציות גל חופפות וה++ עבורנו זה כאילו התהפכות בונה.
אז אני יכול לקחת את האורביטל \( s \) שזה אלקטרון עם הפונקציות גל שלו, לחפוף אותו עם אורביטל \( p_{z} \) של פנוי של גופרית, ועוד אלקטרון מימן עם \( p_{z} \) השני, והנה יצרתי קשר קובלנטי והפעם הקשר הקובלנטי אני יודע שהוא נובע בין \( s \) ל \( p \). עכשיו אני נותן לכם תיאור שהוא יותר ריאלי למה שלמדתם עכשיו אתם אומרים וואו הגיוני וגם מסתדר. למה מסתדר? כי מה שקורה כל מימן מקבל אלקטרון ממנו ומתקיים סביבו כלל שיש לו מה שיש לו שני אלקטרונים וגם פה מתקיים כלל האוקטט כי והספי הגיעו לאוקטט שתיים ארבע שש ועוד שתיים, פה שמונה, אז גם כלל האוקטט התקבל וגם התקדמנו בהבנה שזה אורביטלי \( p \) מתחברים עם אורביטלי \( s \) במרחב, בסדר?
הבעיה היא שהמודל הזה קצת קשה לו לתת לכם מה הסידור המרחבי של מולקולות. הוא התקשה לתת לכם מה הסידור המרחבי של מולקולות, אבל אנחנו נתגבר על זה גם, don't worry.
אז אם אתם מסתכלים על הדבר הזה, אפשר להסתכל עליו מתוך נקודת חפיפה בין אורביטלים. אורביטלי \( p \) של גופרית ואורביטלי \( s \) של מימן חופפים לתת קישור דרך האורביטלים. עכשיו, הבעיה שלנו זה שאנחנו צריכים לדעת מה המבנה ומה הבעיה שלנו. הרבה פעמים אי אפשר מתוך האורביטלים האלה לדעת המבנה ומיד אני אסביר לכם גם למה, בסדר?
סידור האלקטרונים של זרחן ( \( \text{P} \) ): \[ \begin{array}{cccccccc} \text{Phosphorus} & : & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & {\boxed{\uparrow\downarrow} \boxed{\uparrow\downarrow} \boxed{\uparrow\downarrow}} & \boxed{\uparrow\downarrow} & {\boxed{\uparrow} \boxed{\uparrow} \boxed{\uparrow} } \\ & & 1s & 2s & {2p} & 3s & {3p} \\ \end{array} \]
אבל הראייה כעת היא ראייה מתוך אורביטלים, מתוך קישור של פונקציות הגל. למשל, אם אני מסתכל על אטום פחמן, על אטום, סליחה, \( \text{P} \), ואני הולך על האטום הזה, אני רואה שיש לו אורביטלי \( p \). אפשר למשל לקשור אליו וליצור את המולקולה \( \text{PH}_3 \), זה מולקולה ידועה. ואם תלכו לפי ותראו כמה אורביטלים יש לו, יש לו אורביטלי \( p \), שלושה אורביטלי \( p \), מימן מגיע, כל מימן בא ומתקשר עם אורביטל חיובי, אם לא בחיובית, עושה קשר שהוא יוצר חפיפה ואז יצרת לכאן אורביטל והמבנה שייווצר לך כאן הוא מבנה של טריגונל ביפרמידלי, שהאורביטלים האלה נמצאים 90 מעלות זה לזה, אז כאילו החיובי זה אומר שזה פונקציית הגל שעושה את הפחות בונה.
כל פונקציית גל מגיעה עם הצד, כשאנחנו מחברים פונקציות גל, את זוכרת היה או שמחבר בונה או שמחבר הורס, פלוס ופלוס אמרנו מבחינתך שבמשוואה אם היית פותרת אותה, זה שני הגלים יצאו את הפחות בונה. אוקיי אז אפשר לדבר גם כאן על כל מיני הסתדרויות.
\( sp^{3} \)
אבל איפה מתחילה לנו הבעיה? הבעיה מתחילה לנו אם אנחנו רוצים ליצור מולקולות שבאופן עקרוני אני לא יכול לבצע קישור, אבל עדיין אני יודע שהם מבצעים קישור. ניקח לדוגמה את המולקולה הפשוטה ביותר, אם אתם תיקחו את המולקולה לדוגמה \( \text{CH}_4 \). עם \( \text{CH}_4 \) יש לי בעיה ואני אסביר לכם איך אני פותר אותה.
\( \text{CH}_4 \) - היברידיזציה מסוג \( sp^{3} \)
סידור האלקטרונים של פחמן ( \( \text{C} \) ): \[ \begin{array}{cccccc} \text{Carbon} & : & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow \ \ | \uparrow \ \ | \ \ \ \ } \\ & & 1s & 2s & {2p} \\ \end{array} \] \[ \begin{array}{cc} \text{H} & \boxed{\uparrow} \\ & 1s \\ \end{array} \ \ \ \ \ \ \begin{array}{cc} \text{H} & \boxed{\uparrow} \\ & 1s \\ \end{array} \ \ \ \ \ \ \begin{array}{cc} \text{H} & \boxed{\uparrow} \\ & 1s \\ \end{array} \ \ \ \ \ \ \begin{array}{cc} \text{H} & \boxed{\uparrow} \\ & 1s \\ \end{array} \]
אבל בואו ניקח את המולקולה \( \text{CH}_4 \) ואני רוצה לבצע לה כעת קישור מתוך הנקודה או מתוך נקודת מבט אורביטלית. אוקיי בואו נראה איפה הבעיה. כל מימן מגיע עם אורביטל \( s \) נכון? זה קל. יש לי ארבעה עיגולים כאלה של \( 1s \) זה כל מימן. בסדר? לעומת זאת אם כמה מגיע פחמן, כמה אלקטרונים יש לפחמן? שש נכון? לפחמן יש שש נכון? בואו נראה יש לו ככה. \( 1s \) שני אלקטרונים, \( 2s \) שני אלקטרונים ו-1, 2, 3, \( p_{x} \), \( p_{y} \), \( p_{z} \). וכאן יש אלקטרון אחד וכאן יש אלקטרון אחד. נכון? מסכימים? פחמן יש לו שישה אלקטרונים.
\( CH_4 \) \[ \begin{array}{ccc} & \text{H} & \\[-6pt] & | & \\ \text{H} & - \text{C} - & \text{H} \\[-6pt] & | & \\ & \text{H} & \\[-6pt] \end{array} \]
מה? תסתכלי רגע מה זה ארבע? כן כמה אלקטרון יש? אוקיי מסכימים עכשיו איפה הבעיה? דבר ראשון מתוך מודל לואיס אתם יודעים שהמבנה הזה מה צריך לתת? טטראדר נכון? אבל הבעיה בכלל המרכזית כאן איך אני קושר? כי זה לא מסתדר לי. אם אני קושר בצורה כזאת יש לי פה אפשרות לעשות שלושה קשרים. אחד, שניים, שלוש.
אז נניח תלמידים יבואו ויגידו רגע, אז תעשה את זה ככה. תעשה את הקישור בצורה הבאה. שימו לב מה אתם יכולים להגיד לי. אנחנו נעשה את הקישור בצורה שאני אקח כל אורביטל \( 1s \) ואני אכניס אחד לפה ועוד אחד לכאן אורביטל \( s \) ועוד שניים לפה נכון? כי אתם רוצים לעשות קשר נכון? אבל אתה לא יכול לעשות את זה מכמה סיבות. אתה לא יכול לקשור את פעמיים אורביטלי \( s \) לאורביטלי \( p \) ולא מסתדר. לא הולך.
וחוץ מזה כאן יש לו כאילו שלוש אורביטלים של \( p \) שהם מאונכים זה לזה. אם אתה תעשה את זה ככה מבנה שיהיה הוא לא יהיה מבנה של טטרדאדר, הוא יהיה מבנה של 90 מעלות. כלומר האורביטלים האלה של פחמן לכשעצמם הם לא יכולים לתת לך שום דבר. אורביטלים של פחמן כמו שאתה מסתכל עליהם ברגיל הם אורביטלים שנראים מעונחים זה לזה. אז אין לי אפשרות באורביטלים רגילים לקשור את אלה בשום צורה וליצור ארבעה קשרים. אין לי אפשרות. אין לי שום אפשרות כי האורביטלים האלה שהם אורביטלים החיצוניים הם שלושה. אין לי דרך. אם אני קושר עם אחד, קושר עם השני, עם השלישי אין לי אפשרות לקשור. אני לא יכול להכניס שני אורביטלי \( s \) לאורביטל \( p \). במצב הזה כביכול אין לי אפשרות ליצור קשר. אין לי אפשרות ליצור קשר כימי.
אבל מה שבעצם אנחנו עושים, אנחנו עושים תופעה שנקראת היברידיזציה. מה זה היברידיזציה? כאילו אטום המימן מבין שעליו לעשות או אטום הפחמן מבין שעליו לעשות אפשרות ליצור קשר. בעצם יש לנו אורביטל \( s \) ויש לנו אורביטלי \( p \). אוקיי? יש לנו \( s \) ואורביטלי \( p \). אז בעצם מה שקורה כביכול האטום המימן לוקח משני אורביטלי למשתיים \( s \) שלו אלקטרון שהיה משובץ. ככה זה המצב הרגיל. זה המצב הגרונסטייד, המצב העסוד. זה לבצע קישור, הוא עושה תהליך שנקרא היברידיזציה. הוא מערבב אטומים אורביטלים שאצלו לא היו צריכים להתערבב, אבל הוא מערבב אותם. הוא יוצר היבריד, הוא יוצר איזה שהוא בן קיליים. הוא לוקח מ-\( s \) אלקטרון ומקפיץ אותו אינה. וכעת יש לו ארבעה אורביטלים.

וכעת הוא באמת יכול לקשור ארבעה אטומי מימן. עכשיו אין לו בעיה לקשור ארבעה אטומי מימן, אבל הוא לא קושר אותם דרך אורביטל \( p \), אלא דרך אורביטל שהוא קמילציה של \( s \) ו\( p \). הוא הקפיץ אלקטרון ואז הוא לוקח אורביטל \( s \), אורביטל \( p \) מערבב אותם ביחד. במקרה הזה הוא לקח אורביטל אחד של \( s \) ושלושה של \( p \). אז האורביטל הזה יהיה נניח 25% באופי של \( s \) ו75% באופי של \( p \). והאורביטל החדש שיצרנו אנחנו קוראים לא רביטליים החדשים האלה שיצרתי. אני לא קורא להם לאורביטלי \( s \) ולא \( p \), אלא אני קורא להם בשם חדש, \( sp^{3} \), כי לקחתי \( s \) אחד ושלושה \( p \).
\( sp^{3} \), \( sp^{3} \), \( sp^{3} \), ועל כל אחד מהם יש אלקטרון, שזה מצוין במקור, ואז לכל אחד מהם יגיע מימן עם אורביטל מימן, עוד מימן עם האורביטל שלו, עוד מימן ועוד מימן, וכך אני יצרתי את \( \text{CH}_4 \). כעת יש לי ארבעה מקומות ליצור את הקישור, מצוין והכל טוב ויפה.
לפני ואחרי היברידיזציה:
\[ \begin{array}{c|c|c} E & \text{Orbitals} \\ \hline \uparrow & & \text{2p: } \boxed{ \uparrow \ \ | \uparrow \ \ | \ \ \ \ } \\[15pt] \uparrow & \text{2s: } \boxed{\uparrow\downarrow} \end{array} \rightarrow \begin{array}{c|c} E & \text{Hybridized Orbitals} \\ \hline \uparrow & \text{sp}^3: \boxed{\uparrow \ \ | \uparrow \ \ | \uparrow \ \ | \uparrow \ \ } \end{array} \]
מה? בהתאם לאיזה? אז שנייה, איפה אני אסביר? איפה שלוש? האורביטל החדש שאת יצר, הוא כבר לא נקרא אורביטל. מה שאת לוקחת? את לוקחת מהפחמן עצמו. הפחמן עצמו לוקח אלקטרון מ \( s \), מ \( 2s \) שלו, מעביר אותו ל \( p \), מערבב, יוצר ארבעה אורביטלים, הוא לוקח כאילו, בואו אני אסביר לכם שוב, הוא לוקח אורביטל אחד של \( s \), אוקיי? יש לו שתיים \( s \), ויש לו אחד, שתיים, שלוש, של \( p \), שתיים \( p_{x} \), שתיים \( p_{y} \), ושתיים \( p_{z} \), אוקיי? ומצב היסוד, תסתכלי שוב, מצב היסוד שלו, של האטום פחמן, הוא ככה. שימי לב, מצב היסוד, יש שניים פה, שניים כאן, אחד, שניים, עד לכאן בסדר?
עכשיו יש בעיה, בתצורה המרחבית הזאת של האורביטלים, הוא לא יכול ליצור קשר עם ארבעה ממנים, הוא לא יכול, אין מה לעשות, אז כאילו האלקטרון או הפחמן אומר לעצמו, עכשיו אני אעשה קומבינציה עם האורביטלים האחרים שלי. אני אקח את אורביטל \( s \) ואת אורביטלי \( p \), ואני אערב אותם. כמה? אני אקח אחד מ \( s \), אורביטל אחד מ \( s \), וכמה? אני אעשה \( p \) שלושה, אז האורביטל שאני אצור יקרא אורביטל \( sp^{3} \), כי לקחתי אורביטל \( s \) אחד ושלושה אורביטלי \( p \), ויצרתי עכשיו כאן אורביטלים חדשים, בואו נראה, ארבעה, אחד, שניים, שלוש, ארבעה, יצרתי ארבעה אורביטלים חדשים שהשם שלהם זה \( sp^{3} \), מיד אני אראה לך, \( sp^{3} \), \( sp^{3} \), \( sp^{3} \), ואחד מהם אני אשים אלקטרון, ישיר פה אלקטרון, פה אלקטרון, פה אלקטרון, פה אלקטרון.
כעת יש לי ארבעה אלקטרונים באורביטל \( sp^{3} \), ואז כל אחד, כל אחד מהם יכול לבוא אורביטל \( s \) של מימן, לעשות חפיפה וליצור את הקשר \( \text{CH}_4 \). כי אחרת אין לך אפשרות ליצור היויכול בעזרת האורביטלים, אין לך שום קשר, אפשרות ליצור את הקשר \( \text{CH}_4 \). אוקיי, המולקולה \( \text{CH}_4 \), אין לך שום אפשרות ליצור קשר איתה אם את לא עושה היברידיזציה. כן. כן, בדיוק. צריך ליצור ארבעה קשרים, צריך ליצור ארבעה קשרים, אז אני צריך ליצור לפחות שבכל אחד מהם יהיה אלקטרון.
אז איך זה נראה במרחב? במרחב אתה לוקח אורביטל \( s \) ומהרבב אותו עם \( p \). אז זה יראה \( p \) גדול וטיפה \( s \). המבנה המרחבי שלו יראה שונה ואתה תקבל טטראדר. אוקיי, זה לא, האורביטלים החדשים, אורביטלי \( sp^{3} \), הם לא נראים ממש שמינית והם לא נראים ממש עיגול, אלא הם קומבינציה במרחב שנראית יותר דומה למשהו כזה, או יש לך חלק מעיגול וכאן נשאר לך שמינית. אז אם אתם מסתכלים על זה במרחב, מה שעושה מבחינה אנרגטית האטום זה היברידיזציה. הוא לקח שני אורביטלים, היו לו שניים ב \( 2s \) והיו לו שניים ב\( 2p \), והוא יצר היברידיזציה, הוא בעצם מערבב אותם. אז מה שקרה להם, אלה ירדו טיפה ואלה עלו טיפה כי עשיתי ערבוב אנרגטי, וקיבלתי ארבע אורביטלים שהם נקראים \( sp^{3} \), כל אחד מהם קשרתי מימן. אז עכשיו אני יכול להגיד ואת זה אתם תלמדו בכימיה, יגידו לכם קשר \( sp^{3} \). קשר \( sp^{3} \) זה קשר שבו נוצר קישור באורביטלים של \( sp^{3} \). האורביטל הזה שנקשר בו מימן, אני לא אומר מימן נקשר עם \( p \), זה לא אורביטל S P, לא נכון. זה אורביטל \( sp^{3} \) כי המימן בא עם אורביטל \( s \), והוא מתחבר ל\( sp^{3} \) של הפחמן. כדי שהפחמן יוכל לבצע קישור, הוא חייב לעשות ריאורגניזציה של האורביטלים שלו. הדבר הזה שהוא מערב אורביטלים מ- \( s , p \) נקרא היברידיזציה. בצורה הזאת אנחנו יכולים להבין אטומים וקישור אטומים מנקודת מבט אורביטלית. לא מנקודת מבט של לואיס, שזה היה נקודות במרחב. אבל זה לא הקומבינציה היחידה שהוא יכול לעשות.
\( \text{ H }_2\text{O} \) \[ \begin{array}{cccccc} \text{Oxigen} & : & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow | \uparrow \ \ | \uparrow \ \ } \\ & & 1s & 2s & {2p} \\ \end{array} \] \[ \begin{array}{cc} \text{H} & \boxed{\uparrow \ \ } \\ & 1s \\ \end{array} \ \ \ \ \ \ \begin{array}{cc} \text{H} & \boxed{\uparrow \ \ } \\ & 1s \\ \end{array} \]
לפני ואחרי היברידיזציה:
\[ \begin{array}{c|c|c} E & \text{Orbitals} \\ \hline \uparrow & & \text{2p: } \boxed{ \uparrow\downarrow | \uparrow \ \ | \uparrow \ \ } \\[15pt] \uparrow & \text{2s: } \boxed{\uparrow\downarrow} \end{array} \rightarrow \begin{array}{c|c} E & \text{Hybridized Orbitals} \\ \hline \uparrow & \text{sp}^3: \boxed{\uparrow\downarrow | \uparrow\downarrow | \uparrow \ \ | \uparrow \ \ } \end{array} \]
בואו ניקח עוד חומרים ונראה איזה קומבינציות הם עושים, כי יכול להיות הרבה מאוד קומבינציות, בואו נראה מבנה אחר. כן, זה הטטראדר, נכון. למשל אם תסתכלו על מולקולת מים, אם תסתכלו על מולקולת מים, שבמולקולת מים גם יהיה קישור שהוא \( sp^{3} \). גם במולקולת מים יהיה קישור שהוא \( sp^{3} \). וגם במולקולת ניטרוג'ן יהיה קישור שהוא \( sp^{3} \). ובמקרה הזה זה דווקא נראה אחרת, כי מה שאתם מסתכלים, איך אתם עושים את הקישור במולקולת מים. כמה מגיע חמצן? מישהו זוכר מהאורביטלים של חמצן? ברמה סופית, כמה יש לחמצן? \( 2s^2 \) ו\( p_{x} \), \( p_{y} \), \( p_{z} \).
חברים, אתם לא תעברו על זה, אתם תסתכלו עליי בביאה. אבל המבנה האורביטלי של חמצן, זה שיש לו \( 2s \), שני אלקטרונים, ואז יש לו \( 2p \), 1, 1, 1. ועכשיו שהוא הולך לבצע מולקולה קישור עם מים, אתם זוכרים שהמים הם בעצם טטראדר. אז הוא לא יכול ליצור טטראדר עם 3. הוא חייב גם במולקולת המים לבצע ההחלאה שהיא \( sp^{3} \), ואז שני ממנים יכנסו פה, ואז יישארו לו שני זוגות אלקטרונים לא קושרים. גם במים, הקישור הוא דרך מבנה שהוא \( sp^{3} \). וגם באמוניה, אם תעשו \( \text{NH}_3 \) , ותנסו למצוא מה הקישור, אתם תראו שחנקן מגיע באיזושהי צורה, ואז כל הממנים מתחברים לחנקן, אבל חנקן לא נשאר עם אורביטלי \( p \), אלא עובר לאורביטלי \( sp^{3} \). כלומר הרבה פעמים שהאטומים מיווצרו קישור, מה הגיאומטריה המרחבית שהם צריכים להגיע, אם אתה יודע מה הגיאומטריה המרחבית אתה מבין שהם לא יכולים ליצור קשר למשל אם זה טטראדר, מה אם זה טטראדר, אז הוא לא יכול ליצור קשר החמצן עם שני אלקטרונים, הוא חייב ליצור עם ארבע אלקטרונים, כדי ליצור עם ארבע אלקטרונים הוא חייב לקחת אורביטלי \( s \) שלו ואורביטלי \( p \) וליצור אורביטל שנקרא \( sp^{3} \), זה לא הדרך היחידה.
\( sp^{2} \)
יש לנו גם \( sp^{2} \), זה מבנה אחר, אם אתם רוצים לדבר על חומרים, למשל על בורון טריפלואוריד, \( \text{BF}_{3} \), אם אתם מסתכלים על \( \text{BF}_{3} \) ואתם רוצים לעשות את המבנה שלו, בואו נעשה את זה ביחד, זה מייגע קצת אבל נראה שזה אפשרי, בואו נעשה \( \text{BF}_3 \). מה שאנחנו יודעים עליו, על החומר הזה שהוא חייב להיות משולש, נכון? הוא חייב להיות משולש, אין לי מה לעשות, בואו נסתכל איך הוא מגיע, אם תלכו לטבלה מחזורית ותעשו את הרמה האנרגטית האחרונה של BF, אז אתם תראו שיש לו \( 2s \) שני אלקטרונים וב-\( p \) יש לו שלושה \( p \) אבל אחד מהם 2\( p_{x} \) נניח, 2\( p_{y} \) ו-2\( p_{z} \), אוקיי? ופה יש לו אלקטרון אחד רק, מסכימים איתי? מסתכלו בטבלה מחזורית.
\( \text{BF}_{3} \) - היברידיזציה מסוג \( sp^{2} \)
\[ \begin{array}{cccccc} \text{Boron} & : & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow \ | \ \ \ \ | \ \ \ \ } \\ & & 1s & 2s & {2p} \\ \end{array} \] \[ \begin{array}{cc} \text{Fluorine} & \boxed{\uparrow\downarrow | \uparrow\downarrow | \uparrow \ \ } \\ & 2p \\ \end{array} \ \ \ \ \ \ \begin{array}{cc} \text{Fluorine} & \boxed{\uparrow\downarrow | \uparrow\downarrow | \uparrow \ \ } \\ & 2p \\ \end{array} \ \ \ \ \ \ \begin{array}{cc} \text{Fluorine} & \boxed{\uparrow\downarrow | \uparrow\downarrow | \uparrow \ \ } \\ & 2p \\ \end{array} \]
לפני ואחרי היברידיזציה:
\[ \begin{array}{c|c|c} E & \text{Orbitals} \\ \hline \uparrow & & 2p: \boxed{ \uparrow \ \ | \ \ \ \ | \ \ \ \ } \\[15pt] \uparrow & 2s: \boxed{\uparrow\downarrow} \end{array} \rightarrow \begin{array}{c|c} E & \text{Hybridized Orbitals} \\ \hline \uparrow & & 2p: \boxed{ \ \ \ \ } \\[-65pt] \uparrow & sp^{2}: \boxed{\uparrow \ \ | \uparrow \ \ | \uparrow \ \ } \end{array} \]
עכשיו הוא בעצם צריך ליצור קשר משולש, פה אין לו שום אפשרות ליצור קשר משולש עם שום דבר, יש לו אלקטרון אחד לא קושר, כל ה- \( \text{F} \) ים לא יקשרו כאן. מה שהוא עושה בעצם, מה? כן, ל-\( \text{B} \). אז האטום המרכזי עובר היברידיזציה, איך הוא עובר היברידיזציה? הוא עובר היברידיזציה בצורה הבאה: הוא לוקח אורביטלי-\( s \) עם שני אורביטלי-\( p \). במקרה הזה, אם הוא לוקח אורביטל אחד של-\( s \) ושני אורביטלי-\( p \), הוא יצר אורביטל-\( sp^{2} \) כי זה-S1 ו-\( 2p \), נשאר לו אורביטל שני-\( p \) שהוא לא יערבב ואז הוא יצר שלושה אורביטלים שדרכם הוא יכניס את הפלואורים וייצור קשר וישאר לו אורביטל אחד לא קושר.
לכן האטום הזה מבצע קישור, כל קשר כזה יקרה קשר-\( sp^{2} \) כי הוא לקח מ-S1 ו-P2, הוא יצר שלושה אורביטלים, הוא לקח עכשיו יצר קומבינציה חדשה, \( sp^{2} \), \( sp^{2} \), \( sp^{2} \), שזה האורביטלים החדשים שבכל אחד מהם יש אלקטרון כי הוא העביר את האלקטרונים מ-\( s \) לאורביטלים החדשים והאורביטל אחד-\( p \) הוא לא נגע בו, נשאר \( p_{x} \) נניח לא נגע בו שהוא בלתי קושר. ואז אני אומר שבאטום הזה כדי לבצע את הקישור הוא חייב לעשות היברידיזציה שהיא \( sp^{2} \), כן.

אם אני מה? נכון, אז נשאר לי יש לי שלושה אורביטלים שמבצעים קישור ואורביטל אחד רק, כן רק מותר שהיא אורביטל רק שלא עבר היברידיזציה, מה? לא חייב. את יכולה לקבוע, נחר והמזהים זה יכול להיות \( p_{z} \), \( p_{y} \), \( p_{w} \), ומה שאת רוצה זה לא חשוב. ושוב, ההיברידיזציה כאן שונה, זה נראה כבר אחרת, יש לה יותר אופי מעגלי, אתה לוקח אחד \( s \) עם שני \( p \) ויוצר שלושה אורביטלים שיכולים לתת לך את המבנה המשולש הזה, זה כבר נראה אחרת במרחב, זה לא אורביטל \( s \) וזה לא אורביטל \( p \).
זה למשל היברידיזציה שנקראת \( sp^{2} \).
\( sp \)
\( \text{BeCl}_{2} \) - היברידיזציה מסוג \( sp \)
\[ \begin{array}{cccccc} \text{Be} & : & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\ \ \ \ | \ \ \ \ | \ \ \ \ } \\ & & 1s & 2s & {2p} \\ \end{array} \] \[ \begin{array}{ccc} \Large{\cdot\cdot} & & \Large{\cdot\cdot} \\[-16pt] \mathbf{:}\text{Cl} & - \text{Be} - & \text{Cl}\mathbf{:} \\[-6pt] \Large{\cdot\cdot} & & \Large{\cdot\cdot} \\[-16pt] \end{array} \]
אתה יכול לעשות גם היברידיזציה של \( sp \) לקחת אחד \( s \) ואחד \( p \), למשל בבריליום כלוריד ( \( \text{BeCl} \) ), כשלוקח בריליום כלוריד הוא לינארי, זה מבנה לינארי בריליום כלוריד. אז הבריליום מגיע, אם תעשו לגבי בריליום, הוא מגיע עם \( 2s \) ויש לו עוד אורביטלי \( p \) ריקים. עכשיו לפי השיטה שלנו, אם הוא מגיע עם \( 2s \) איך הוא בכלל קושר? מה פתאום שהוא קושר בזה כי אין לו מה לקשור, כל האורביטלים שלו מלאים. אבל בעצם מה שהוא עושה הוא לוקח מ-\( s \) ומ-\( p \), הוא לוקח אורביטל אחד מ-\( s \) ואחד מ-\( p \) ויוצר שני אורביטלים שהם \( sp \), שפה יהיה אלקטרון ופה יהיה אלקטרון.
\[ \begin{array}{c|c|c} E & \text{Orbitals} \\ \hline \uparrow & & 2p: \boxed{ \ \ \ \ | \ \ \ \ | \ \ \ \ } \\[15pt] \uparrow & 2s: \boxed{\uparrow\downarrow} \end{array} \rightarrow \begin{array}{c|c} E & \text{Hybridized Orbitals} \\ \hline \uparrow & sp: \boxed{\uparrow \ \ | \uparrow \ \ } \end{array} \]
והכלורים יבואו ייכנסו כאן, כל אחד מהכלורים יבוא עם ה-\( p \) שלו ייכנס כאן וישארו לו שני אלקטרונים, שני אורביטלים שהוא לא נגע בהם של \( p \). למשל \( p_{x} \), \( p_{y} \), זה יהיה אלם. אז הוא עשה היברידיזציה שנקראת \( sp \), הוא לקח \( sp \) ו-S1 ו-\( p \) אחד. אז בעצם אם אנחנו רוצים להבין קישורים מתוך נקודת מבט של אורביטלים, אנחנו דבר ראשון עושים את המבנה לואיס, קובעים את המרחב, ולפי המרחב אני צריך להגיד עכשיו: אוקיי, כמה קשרים צריך האלקטרון? כמה אורביטלים יש לו? ואני כאילו יוצר בראש איזשהו היברידיזציה שהאלקטרון עושה כדי לבצע את הקשרים האלה. זה מודל שהוא מודל על בסיס האורביטלים, שהוא הראייה, זה נקרא Valence bond, זה על \( p \) אורביטלים, והראייה אומרת אלקטרונים נקשרים או חומרים נקשרים בגלל חפיפה בין אורביטלים.
חפיפה בין האורביטלים תיתן לי את הקשר הרצוי. ישנם מצבים שזה עובד מצוין. יש לי אורביטלי \( p \) פנויים ואורביטלי \( s \) פנויים. למשל במולקולה \( \text{H}_2\text{S} \). זה עובד מעולה, אבל יש לנו מולקולות לפעמים שזה לא יעבוד בהם טוב. למשל PH5, זה עובד מעולה גם, אבל ישנן מולקולות שנדרשת היברידיזציה כמו במולקולה \( \text{CH}_4 \). כדי ליצור קשר \( \text{CH}_4 \), אתם רואים שלפי הירחות במצב בסיס שלו הוא לא יכול ליצור ארבעה קשרים. הוא יכול מקסימום ליצור שלושה, אבל אני יודע שיש לי \( \text{CH}_4 \), זה נסי היברידיזציה.
אני לוקח אורביטל \( 1s \) ו-4P, ושלושה מ-\( p \), ויוצר אורביטל עם ארבעה חדשים. \( 1s \), \( 3p \), יצרתי ארבע אורביטלים חדשים. האורביטלים האלה נקראים \( sp^{3} \), וכעת הוא יכול ליצור ארבעה קשרים. ואתה יכול לקחת \( 1s \) ו-\( 2p \), וזה יקרה \( sp^{2} \), ואתה יכול לקחת \( 1s \) ו-1P, זה נקרא אורביטלי \( sp \). אז מתוך ראייה של קישור אתה יכול ליצור.
\( sp^{3}d \) ו-\( sp^{3}d^{2} \)
עכשיו תשאלו: מה קורה עם קשרים יותר מורכבים? יותר מורכבים מזה? יש לנו מצבים שהם הרבה יותר מורכבים, ואתה יכול להכיל או לעשות היברידיזציה בכמה אורביטלים. לא רק בעזרת אורביטלים של \( s \) ו-\( p \), אתה יכול גם ליצור אם אתה צריך ליצור חמישה ושישה קשרים, אז אין לך בעיה, אין לך ברירה. במקרה של חמישה קשרים או שישה קשרים, אם זה חמישה קשרים, אתה תיקח שלושה קשרי \( s \), שלושה קשרי π, ו-\( d \), ואז ההיברידיזציה תקרא \( sp^{3}d \). ואם אתה צריך ליצור שישה קשרים, אין לך ברירה, אם אתה יוצר שישה קשרים, אתה צריך לקחת אורביטל \( 1s \), שלושה אורביטלי \( p \), ושני אורביטלי \( d \). רק ככה אתה יוצר חמישה אורביטלים לקישור, ואז ההיברידיזציה נקראת \( sp^{3}d^{2} \).
אז כל אטום שאתם תקבלו שיש בו ארבעה חמישה קשרים, אתם חייבים מתוך נקודת מבט של חפיפת אורביטלים, אתם חייבים ליצור חמישה אורביטלים. איך אפשר ליצור חמישה אורביטלים? אם לוקחים אחד מ-\( s \), שלושה מ-\( p \), ואחד מ-\( d \). אם אתם צריכים שישה קשרים, כל קשר שתעשו, כל מבנה לואיס שתעשו ותקבלו אוקטאדר, מבנה של אוקטאדר, אתם יודעים שהאטום המרכזי חייב ליצור שישה אורביטלים. איך הוא יכול ליצור שישה? הרי יכול להיות או אחד \( s \), או שלושה \( p \), או חמישה \( d \). אז איך יוצרים שישה? עושים קומבינציות, לוקחים אחד \( s \), שלושה \( p \), ושני \( d \), וביחד מגיעים לשישה אורביטלים. ההחלאה הזאת יקרה \( sp^{3}d^{2} \).
אז החלאות כאלה הן כבר שילובי אורביטלים שונים, יכול להיות \( sp^{3}d \), כדי ליצור חמישה קשרים, ו- \( sp^{3}d^{2} \), כדי ליצור שישה קשרים. מתייחסים? לא, כי אתה תמיד תעשה עם אותה רמה, אתה לא תעשה, אם אתה עושה עם \( s \), אז זה \( 2s \) עם ה-\( p \) שלו. אם אתה תעשה את האורביטלים הזה, אז זה יהיה \( 3s \), \( 3p \), ו-\( 3d \), זה באותה רמה. אתה לא עושה החלאות עם רמות קוונטיות נמוכות יותר. טוב, לא נורא, קצת מורכב, אבל לא יהרוג אתכם.
רגע, חכו, מי רוצה הפסקה? מי ביקש? כולכם? מה זה, כזה קשה? אבל התחלנו לפני פחות משעה. כן? הופה, אז תחזרו לכאן בעשר ועשר וחצי, עשרים דקות, לא? לא, עשר עשרים וחמש. לא לא, עשר עשרים וחמש נחזור. לא להתייש.
נחזור למה אני רוצה לדבר איתכם, אני רוצה לדבר איתכם כעת על קישור מנקודת מבט של אורביטלים, אוקיי? עכשיו, כל העניין פה שאתה משלב כמה דברים. אתה משלב את הידע על המבנה של המולקולה מתוך המודל של VSEPR, של דחיית אלקטרונים. אתה משלב ידיעה של אורביטלים, וכעת אתה רוצה לשלב את כולם ביחד כדי להבין איזה קשרים ואיזה אורביטלים חייבים להימצא.
למשל, במולקולה \( \text{H}_2\text{S} \) זה נורא פשוט, כי אתה אומר לאורביטלי \( s \) מגיעים אם הוא שני אורביטלים. אתה עושה את האורביטל, אם אתה אומר יש לו שני אורביטלי \( p \), הוא צריך לחבר שני אורביטלי \( s \). אתה מחבר כל אורביטלי \( s \) חופף עם אורביטלי \( p \), ואתה יוצר את המולקולה וזה מתאים. זה מסתדר למבנה באמת שצריך להיות והכל עובד מצוין, אין בעיה.
אותו דבר אם אתה לוקח את, למשל, את המולקולה \( \text{PH}_3 \), זרחן תטריהידרוג'ן. כי הפחמן מגיע עם 3. כל \( p \) שלא פנוי, כל אחד מהמימנים ייכנס, יהיה לו אוקטט, למימנים יהיה אוקטט. המבנה המרחבי מצוין, ואז כל אורביטלי \( s \) מגיע עם אורביטל \( p \), \( p_{x} \), \( p_{y} \), \( p_{z} \). המבנה מתאים לך מצוין, כי זה מבנה של טריגונל פרמידלי מצוין. אז יש מצבים שבהם האורביטלים כמו שהם מגיעים, זה מצוין לך, אין לך שום בעיה, הכל עובד יפה.
אבל ישנם מצבים שבהם אתה עושה מבנה, וזה לא מסתדר. הדוגמה הכי פשוטה זה \( \text{CH}_4 \). \( \text{CH}_4 \), אני יודע את הדבר הבא: שהאורביטל הזה, דבר ראשון, זה טטראדר, אוקיי? זה טטראדר, ככה הוא מופיע. יש לי כאן טטראדר, ארבעה קשרים שונים. אם אני אקח את הפחמן, אני יודע, כל אחד מהמימנים מגיע עם \( s \). כאן אין לי מה לשחק הרבה, כל אחד מהאורביטלים מגיע עם אחד \( s \) שהוא מעגלי. אין מה לעשות פה, ויש ארבע כאלה.
עכשיו אני מסתכל על הפחמן, ואני שואל את עצמי איך הפחמן מגיע. הפחמן מגיע עם אורביטל \( 2s \), שיש בו שני אורביטלים, שניים, סליחה. \( 2s \) שמגיעים עם שני אלקטרונים. אחרי זה יש לו אורביטלי \( p_{x} \) נניח, \( p_{y} \), \( p_{z} \), אוקיי? ואני הולך ועכשיו ממלא את האלקטרונים, ואני רואה שבמצב הרגיל, מה שנקרא במצב ground state, במצב יסוד שלו, אין לו אפשרות ליצור ארבעה קשרים. אין אפשרות. מקסימום הוא יכול ליצור שלושה קשרים: אחד, שניים, שלוש. הוא לא יכול ליצור שום דבר אחר למעט זה.
אבל אני יודע מתוך המבנה של דחיית האלקטרונים ומבנה לואיס, שזה חייב להיות טטראדר. אני צריך ארבעה קשרים. ארבעה קשרים שכולם זהים. לא מסתדר עם האורביטלים הזה, כי אני לא יכול להגיד שיגיע לכאן מימן אחד, ויגיע לכאן עוד מימן, ולכאן יגיע עוד מימן. בסדר? ומה? זהו. אין לי אפשרות ליצור יותר קשרים.
אז מה שאני עושה במצב כזה, אני כאילו מאניש את מלשון האנשה. אני הופך אותם להנפשה כזה את האורביטלים, ואני אומר שהאטומים עושים היברידיזציה. כאילו האטום יודע שהוא צריך ליצור אורביטלים. איזה אורביטלים הוא ייצור? הוא ייקח אורביטל חדש, הוא יגיד לעצמו ככה. אוקיי, הפחמן יגיד, אני אקח אחד \( s \) ושלושה מהאורביטלים האלה, ואני אערבב אותם ביחד.
הופה, בואו נראה שוב, יש לו כאן \( 2s \) עם אחד ואחד, ואחד, שניים, שלוש, שיש בהם אחד ואחד, וזה \( p_{x} \), נניח \( p_{y} \), ו\( p_{z} \). עכשיו הוא יערבב אותם, והוא ייצור משהו פה באמצע, אורביטל חדש. הוא ייקח \( s \) אחד ושלושה \( p \), והוא ייצור ארבע אורביטלים חדשים. ועכשיו הוא יכול לבצע קשר של ארבעה. האורביטלים האלה נקראים \( sp^{3} \), כי לקחתי שלושה \( p \) ואחד \( s \).
בואו נראה כמה אלקטרונים יש בהם, ארבע, אז אחד כאן, אחד כאן, אחד כאן, ואחד כאן. אוקיי, ועכשיו הוא בהחלט יכול לקשור ארבעה פחמנים, ארבעה מימנים. יבוא לפה מימן אחד, יבוא לפה עוד מימן, עוד מימן עם ה-\( s \) שלו, ועוד אחד, ויצרתי קשר. המקרה הזה, אני אומר, שעתום עשה היברידיזציה שנקראת \( sp^{3} \). הוא לקח \( s \) אחד ושלושה \( p \), ויצר ארבעה אורביטלים חדשים, והוא יכול ליצור עכשיו ארבעה קשרים. מעולה. מצוין.
איך זה נראה במרחב? אתה לוקח אורביטל אחד שהוא \( s \), ושלושה אורביטלי \( p \), ועושה להם 25 אחוז, הם יהיו בעלי אופי \( s \), ו-75 אחוז בעלי אופי \( p \). יצרתי אורביטל חדש שהשם שלו במרחב זה \( sp^{3} \). האם זה האופציה היחידה שלי? לא, יש כל מיני אופציות ואנחנו נמשיך הלאה.
אפשרות נוספת, וזה ככה זה נראה. עכשיו שימו לב שזה נמצא באנרגיה בין שניהם. זה לא בגובה של \( p \) וזה לא בגובה של \( s \). חיברתי את ביניהם וזה יותר קרוב ל-\( p \), כי לקחתי שלושים וחמש אחוז מ-\( p \). אז זה יהיה טיפה יותר קרוב ל-\( p \), זה לא יהיה כאן, זה יהיה יותר קרוב ל-\( p \). ועשיתי, כן, 75 יורד, 35 עולה, אוקיי? יצרתי את זה.
עכשיו, איך אני, למה עשיתי את זה? כי ידעתי שחייב להיות טטראדר, וידעתי שחייב להיות ארבעה קשרים, ולכן הפחמן, אם אני רוצה לחשוב עליו מבחינה אורביטלית, אין לו ברירה, הוא חייב לעשות mixing, הוא חייב לערבב אורביטלים. הדבר הזה של ערבוב אורביטלים נקרא היברידיזציה. הוא לוקח אורביטל נמוך ואורביטל. עכשיו, כל האורביטלים נלקחים מאותה רמה. הוא לא לוקח \( 1s \), הוא לוקח את הרמה \( 2s \) עם \( 2p \), וההבדלים ביניהם באנרגיה לא כאלה גדולים, הוא מערבב אותם כדי ליצור אפשרות ליצור יותר קשרים.
למשל, אם אתם תסתכלו במולקולת מים, אתם שוב יודעים שמולקולת המים היא, מה המבנה של מולקולת מים לפי המודל שלנו? טטראדר, נכון? אז חייב להיות, מי האטום המרכזי זה חמצן. אם תסתכלו על חמצן, הוא מגיע עם שני אלקטרונים כאן ושלושה אורביטלים. אם הוא חייב, כמו מים, ליצור טטראדר, אם הוא חייב ליצור טטראדר, הוא חייב לעשות היברידיזציה. אבל תראו, אף-על-פי מה קורה כאן.
בעצם אני לוקח שני אלקטרונים פה ומעביר אותם, ואז אני מעביר שני אלקטרונים לזה, אז יש לי 1, 2, 3, אז זה 1, 2, 3, ועוד שני אלקטרונים שהעברתי פה, ואז מולקולות המים יכולות להיקשר, ויהיה לי שניים שהם נמצאים קשורים ושניים לא קושרים. זה במולקולת מים. מה זה? לא הבנתי. זה ל-3, נכון? כי אז יש לך זוג אלקטרונים לא קושר, במים זה עוד אלקטרון להוסיף לכאן כאן, ואז יש לך שניים לא קושרים, ב-\( sp^{3} \) ושתיים קושרים.
\( sp^2 \)
אוקיי? זה למולקולה הזאת, בסדר? עכשיו, \( sp^{2} \) זה מקרה אחר. \( sp^{2} \) זה שלמשל אתה לוקח ואתה יוצר בעזרת \( s1 \) ושני \( p \), אתה יוצר שלושה אורביטלים חדשים. זה עבור מולקולה כמו \( \text{BF}_6 \), \( \text{BF}_6 \) או \( \text{BF}_3 \), אתה רואה שכדי ליצור אותה, ה-BA מגיע עם שני אלקטרונים ושניים כאלה, אוקיי? והוא יוצר את זה על ידי יצירת \( sp^{2} \). במקרה הזה זה אורביטל שנקרא \( sp^{2} \), יוצר שלושה. וככה נראה המבנה שלו, אתה לוקח אחד של \( s \) ושניים של \( p \).
והמבנה האחרון זה מבנה \( sp \), בריליום כלוריד ( \( \text{BeCl} \) ), שאתה לוקח אחד \( s \) ואחד \( p \) ויוצר אורביטל. \( sp \) ונשארים לך שני \( p \). זה האורביטלים שאתה יוצר. אמרתי, המקרים נהיים יותר חמורים אם אתה צריך ליצור, ראינו, ליצור ארבעה קשרים, שלושה קשרים, שני קשרים. מה קורה אם אתה צריך ליצור חמישה קשרים? יש הרי מבנים אוקטי-הדרליים. אנחנו זוכרים שיש מבנה כמו P4-5, זה מבנה עם חמש, או S4-6, זה שש, במקרה הזה אתה צריך חמישה אורביטלים או שישה. זה טיפה יותר מורכב.
במבחן אני לא אשאל אתכם, אבל בכימיה אורגנית יכולים להגיד לכם, דרך אורביטלי \( sp^3d^2 \), שתדעו מה מדובר. מה הכוונה? במקרה כזה, כדי ליצור חמישה אורביטלים, אני אקח אורביטל \( s \), שלושה \( p \) ועוד אורביטל \( d \). בסך הכול, יש לי חמישה: שניים, אחד, שלוש, זה ארבע, חמש, ואז האורביטל יהיה \( sp^{3}d \). הוא יעשה קומבינציה משלושה אורביטלים, אחד \( s \), שלוש \( p \) ואחד \( d \). ואם הוא צריך לעשות שישה קשרים, אז השישה קשרים מבוצעים מקשר \( s \), שלושה \( p \) ושני \( d \).
אז גם הרבה פעמים יש אנשים אומרים לי, עזוב אותי לזכור בעל-פה, אני יודע מה מבנה, וישר אני יכול לדעת מה האורביטלים שיהיו. כי אם אני יודע שזה טטראדר, זה חייב להיות \( sp^{3} \). אם אני יודע שזה אוקטאדר, זה חייב להיות \( sp^{3}d \). יש כאלה שזוכרים בעל-פה, אומרים, עזוב, אם זה ליניארי, זה חייב להיות \( sp \). אתם רוצים לזכור ככה, תזכרו ככה, בסדר? אבל באופן עקרוני אתה יכול לקחת את כל האורביטלים, הקומבינציות האורביטליות לפי המבנה הגיאומטרי. ובעצם המבנה הגיאומטרי נותן לך את המבנה הזה. אז אתה עושה מבנה, אתה מוצא את הגיאומטריה, ומתוך הגיאומטריה אתה מוצא את ההיברידיזציה הרצויה.
אוקיי? ככה עושים את זה.
אתילן
עכשיו אני רוצה להראות לכם משהו מעניין לגבי המולקולה הזאת. אני רוצה ללמד אתכם משהו שישמש אתכם לכימיה האורגנית בהמשך. C, אם אני מסתכל על המולקולה הזאת, שהיא C2H4, C2H4, אוקיי? המולקולה הזאת, המבנה שלה הוא כדלקמן. יש לי כאן קשר כפול, מימן מימן. אוקיי, עכשיו בואו נראה איזה מבנה זה צריך להיות. המבנה כאן צריך להיות, מישהו יודע להגיד לי מה הוא?
מבנה לואיס של \( \text{C}_2\text{H}_4 \) יהיה: \[ \begin{array}{c} \ \ \ \ \ \ \ \ \ \text{H} \ \ \ \ \ \ \ \ \ \text{H} \\ \ \ \ \ \ \ \ \ \ \ \backslash \ \ \ \ \ \ / \\ \ \ \ \ \ \ \ \ \ \ \ \ \text{C} = \text{C} \\ \ \ \ \ \ \ \ \ \ \ \ / \ \ \ \ \ \backslash \\ \ \ \ \ \ \ \ \ \ \text{H} \ \ \ \ \ \ \ \ \ \text{H} \\ \end{array} \]
לפחמן הזה איזה מבנה יש? זה AX3, 1, 2, 3. אז כלומר, איזה מבנה זה? לא טטראדר? מה זה? משולש. מה קורה לכם חבר'ה, אתם אמורים להיות מוצלחים, לא? עוד פעם, מה אנחנו מסתכלים על אטום מרכזי? אטום מרכזי, פחמן. כמה יש מסביבו קושר? אם זה קשר כפול או משולש משנה? סופר אחד, 1, 2, 3. X1, בורדאי. אוקיי, אז מה יש לכם כאן זה AX3. כלומר, מה הזווית כאן בערך? 120. בסדר?

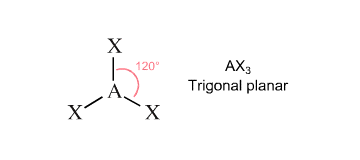
אז עכשיו, רגע, רגע. אם כך, איזו היברידיזציה הוא צריך לעשות? איזו היברידיזציה הוא צריך לעשות? הוא צריך ליצור כמה? כמה הוא צריך ליצור? שלושה, נכון? אז הוא צריך לקחת \( s \) אחד ושני \( p \). עד לכאן בסדר? איזה מבנה, איך תפסיק את זה? מה? תגיד איך תפסיק את זה, תגיד כמה...
אוקיי, כמה הקשרים הוא צריך לעצור? שלושה. אז הוא צריך לקחת S1, נכון? בואו נראה את הפחמן ברגיל. שנייה, הביאתי, הביאתי ברגיל. תהיו איתי כאן בהקשבה, אל תכתבו. אל תסתכלו בגוגל, אל תהיו בטיקטוק, אליי. תראו, הוא צריך ליצור שלושה. כי אתה יודע ממבנה VSEPR מה צריך להיות המבנה. את זה אתה יודע כבר. זה חייב להיות 120 מעלות, זה חייב להיות מרצדס.
\[ \begin{array}{cccccc} \text{Carbon} & : & \boxed{\uparrow\downarrow} & \boxed{\uparrow\downarrow} & \boxed{\uparrow \ \ | \uparrow \ \ | \ \ \ \ } \\ & & 1s & 2s & {2p} \\ \end{array} \]
חיץ שזה היה מרצדס. בסדר? חייב להיות ככה, אוקיי. אז מה אתה אומר? הוא חייב... הנה המבנה של פחמן. הנה פחמן, ככה מגיע פחמן. \( 2s \). אבל הוא צריך שלושה קשרים. אז הוא ייקח אחד \( s \) וכמה מה-\( p \)? שתיים. ואם כך הוא ייצור איזו היברידיזציה? \( sp^{2} \). ויישאר לו \( p \) אחד, רק \( p \) אחד נשאר. אז מה הוא עושה? עכשיו תראה איזה יופי. עם כל, עם מימן, מימן, מימן, מימן. סליחה, קשר, קשר, קשר. הוא יוצר אותם פה, מכניס אותם פה. עד לכאן, בסדר?
ונשאר לו, כן? שלושה נכנס כאן. מימן, מימן והפחמן החבר. מימן אחד מכניס קשר פה. עוד מימן מכניס קשר פה. והפחמן הזה מכניס קשר פה. והוא נשאר עם \( p \) אחד, מה איתו? לא קושר, נכון? נשאר לו \( p \) אחד לא קושר. אם נסתכל על הפחמן השני, זה בדיוק אותו דבר, נכון? אז מה שקורה? לשניהם בסוף נשאר \( p \) אחד עם אלקטרון לא קושר. לשניהם נשאר \( p \) אחד עם אלקטרון לא קושר.
\[ \begin{array}{c|c|c} E & \text{Orbitals} \\ \hline \uparrow & & 2p: \boxed{ \uparrow \ \ | \uparrow \ \ | \ \ \ \ } \\[15pt] \uparrow & 2s: \boxed{\uparrow\downarrow} \end{array} \rightarrow \begin{array}{c|c} E & \text{Hybridized Orbitals} \\ \hline \uparrow & 2p: \boxed{ \uparrow \ \ } \\[-65pt] \uparrow & & sp^{2}: \boxed{\uparrow \ \ | \uparrow \ \ | \uparrow \ \ } \end{array} \]
הם עשו דרך ה-\( sp \) קישור, ואז הם יחפפו את ה-\( p \) עם הלא קושרים האלה. לקשר הכפול. מה? זה נשאר שני \( p \). נכון? והשני \( p \), אז עכשיו מה קורה? הביטי, הביטי. מה קורה? כל אלה שקשורים דרך ההיברידיזציות נקראים סיגמה (\( \sigma \)). הוא עשה \( sp \) ויצר את המשולש. הנה המשולש הזה שלו, אוקיי?
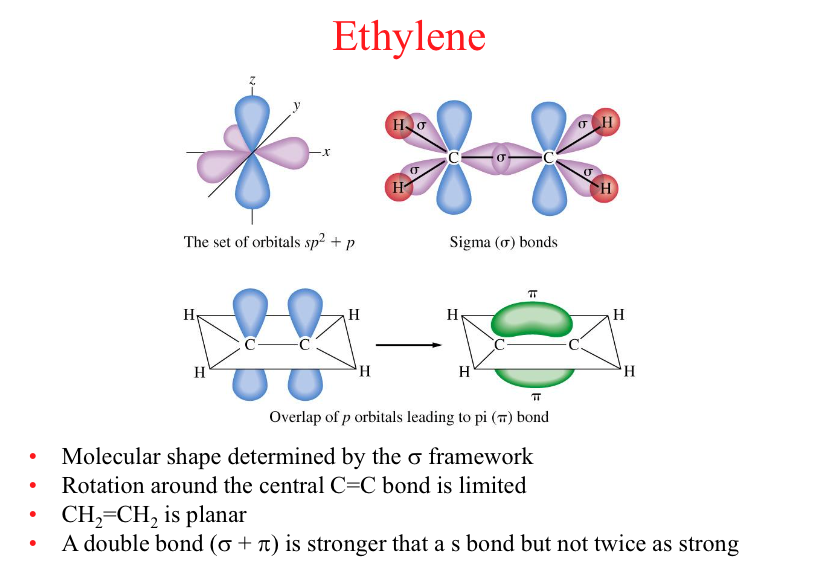
אז הקשרים שקשורים דרך האורביטלים שהם \( sp^{2} \), זה נקרא קשר \( \sigma \), זה נקרא קשר \( \sigma \) וזה גם \( \sigma \). אבל היה לו עוד אורביטלים ב-\( p \), שהיה פה אלקטרון לא קושר ופה אלקטרון לא קושר. הוא חופף אותם ביחד. ברגע שהוא חופף את האלקטרונים הלא קושרים שלו ב-\( p \) ושל זה ב-\( p \), הם יוצרים קשר כפול, והקשר השני נקרא קשר פאי (\( \pi \)).
אז... איפה? הנה, שוב נחזור ונראה את ההיגיון. הוא צריך ליצור... הגיאומטריה שלו עוד פעם. ההיגיון, אני אתן לך את ההיגיון. דבר ראשון, אתה קובע את הגיאומטריה של המולקולה. לפי הגיאומטריה, אתה יודע כמה קשרים היא צריכה לעשות. לפי כמה קשרים שהיא צריכה לעשות, אתה יודע איזו היברידיזציה צריכה לקרות. אם זה ארבעה קשרים, איזו היברידיזציה זאת? \( sp^{3} \), כי הוא צריך ארבע, אז הוא לוקח \( s \) ושלושה \( p \). אם זה שלושה קשרים, זה \( sp^{2} \). אם את רוצה, תלכי ככה, לפי, כן, כן.
נכון? הוא ייקח מה-\( s \) ועוד שניים מה-\( p \) יצור \( sp^{2} \). נכון? אז כל הקשרים האלה שהם דרך, האורביטלים האלה, הקושרים נקראים \( \sigma \). ואז נשאר לו אלקטרון אחד לא קושר \( p \), וגם לשני לא קושר. הם נקשרים, ואלה נקראים, משלמנזים אותם ב-\( p \) לא קושר. שני ה-\( p \) הלא קושרים יוצרים ביניהם קשר, וזה נקרא קשר \( \pi \).
קשרי \( \sigma \) וקשרי \( \pi \) של פחמן במולקולת \( \text{C}_2\text{H}_4 \)
\[ \begin{array}{c} \ \ \ \ \ \ \ \ \text{H} \ \ \ \ \ \\ \ \ \ \ \ \ \ \ \ \ \sigma \backslash \ \ \ \ \pi \\ \ \ \ \ \ \ \ \ \ \ \ \ \text{C} = \\ \ \ \ \ \ \ \ \ \ \ \ \ \sigma / \ \ \ \sigma \ \ \ \ \\ \ \ \ \ \ \ \ \ \text{H} \ \ \ \ \ \\ \end{array} \]
אוקיי? אז במולקולה כזאת יש שלושה קשרי \( \sigma \), שהם דרך ההיברידיזציה, ושניים לא קושרים, שזה ה-\( p \). בסדר? זה? לא? שלושה כי אם את מסתכלת על הקשר זה יהיה אחד מהם \( \sigma \) \( \sigma \) \( \sigma \) זה יהיה \( \sigma \) \( \sigma \) \( \sigma \) ופה ביניהם הקשר הנוסף הכפול הוא קשר \( p \) כי זה חפיפה של אורביטלי \( p \) שלא עברו היברידיזציה. מי שאלה? כי זה אני אני לא רואה.
אצטילן
אוקיי עכשיו יכול להיות מולקולה יותר מסובכת הנה המולקולה הבאה אצטילן ( \( \text{C}_2\text{H}_2 \) ). זאת המולקולה שידועה מה עושים עם המולקולה הזאת? אתם יודעים מה עושים עם אצטילן? אצטילן זה המברי שאתם מבהירים שאתם הולכים למשל לצורף והוא מתיך מתכת ומבהיר או שאתם עושים ריתוך עם זה. זה אצטילן. גז אצטילן בוער מצוין. מוסיפים אותו פטיפה עם חמצן ואפשר לחתוך מתכת. אוקיי זה אצטילן.
קשרי \( \sigma \) וקשרי \( \pi \) של פחמן במולקולת \( \text{C}_2\text{H}_2 \)
מבנה לואיס של אצטילן: \[ \begin{array}{c} \text{H} - \text{C} \equiv \text{C} - \text{H} \\ \end{array} \]
אבל נדע דבר ראשון, איזה היברידיזציה יש לו? כמה קשרים הוא יוצר? איזה מבנה חייב להיות לו? לזה AX כמה? שתיים. כלומר שזה חייב להיות לינארי, נכון? לינארי. כלומר, הוא צריך ליצור שני קשרים. אז איזו היברידיזציה הוא יעשה אם הוא צריך ליצור שני קשרים? \( sp \). הוא לוקח אחד \( s \) ואחד \( p \). הנה שני אורביטלי \( s \) שלו, שלושה אורביטלי \( p \). הוא ייקח אחד \( s \) ואחד \( p \) ייצור את ה-\( sp \). איתם הוא יקשור את המימנים. איתם הוא יקשור את המימנים. זה יהיה \( \sigma \) ופה \( \sigma \). ואז יש לו בין הפחמנים קשר נוסף גם \( \sigma \) ושני האחרים שנותרו יש לו שני אורביטלי \( \pi \).
\[ \begin{array}{c|c|c} E & \text{Orbitals} \\ \hline \uparrow & & 2p: \boxed{ \uparrow \ \ | \uparrow \ \ | \ \ \ \ } \\[15pt] \uparrow & 2s: \boxed{\uparrow\downarrow} \end{array} \rightarrow \begin{array}{c|c} E & \text{Hybridized Orbitals} \\ \hline \uparrow & 2p: \boxed{ \uparrow \ \ | \uparrow \ \ } \\[-65pt] \uparrow & & sp: \boxed{\uparrow \ \ | \uparrow \ \ } \end{array} \]
מעונכים זה לזה שהם יוצרים ביניהם חפיפה בלי היברידיזציה. זה מבנה מרחבי שתוצאה. אז בעצם מה שעושה כל פחמן? יוצר קשר \( \sigma \) עם מימן, עוד קשר \( \sigma \) עם מימן עם הפחמן השני. וזה נוצר דרך אורביטלי ההיברידיזציה. ואורביטלים שלא עברו בכלל היברידיזציה ונשארו טהורים \( p \). הוא יוצר עם העליונים והצדדים שניים וזה שני קשרים \( p \).
כן. נכון. כן כן כן כן. קשר רגיל הוא יהיה \( \sigma \). קשר כפול \( \pi \) (דור: להבנתי בנוסף לסיגמה הקיים). קשר משולש \( \pi \) נוסף. בסדר? עוד פעם, אם יש לך קשר רגיל בין אטומים הוא יהיה \( \sigma \). קשר כפול יהיה \( \sigma \) והכפול חייב להיות \( \pi \). וקשר משולש זה \( \sigma \) והכפול השני \( p \) \( p \). אז בוא נו תלמדו את זה תראו.
\[ \begin{array}{c} \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \sigma \ \ \ \ \ \ \pi \\ \ \ \ \ \ \ \ \ \ \ \ \text{H----} \text{C} \equiv \\ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \sigma \ \ \ \pi \ \ \ \ \\ \end{array} \]
מה שהיא רצתה להגיד? מה שמח? תמרה תמרה אמרה אם כך אני מלמדת, היא לא אמרה את זה בצורה הזאת. אני מלמדת כך שאם יש לך קשר אחד רגיל זה יהיה \( \sigma \). קשר כפול חייב להיות \( p \). ומשולש חייב להיות \( p \). מסכימים איתה או לא?
כן. כך. יאללה, בואו נתקדם חברים. יש דברים שאתם צריכים להפנים.
MO Theory
(a) \( \text{Z} \geq 8 \)
(b) \( \text{Z} \le 7 \)
אוקיי עכשיו נקודה אחרת. עכשיו עשו, עשו, עשו, עוברים למודל קישור נוסף. כל המודלים האלה לקישור, המטרה שלהם שתבינו קשר כימי. בזה אנחנו גומרים את מודל הקישור. איפה תתקלו עוד פעם בהיברידיזציות ובקישור כימי? בכימיה האורגנית, כי הרבה פעמים יגידו לכם שקשר \( p \) הוא קשר שנפתח בקלות ביחס ל-\( s \), וכל ההתמרות נעשות על קשרי \( p \). תשאלו, מה זה קשר \( p \)? יגידו לכם, אטום שמגיע עם אורביטלי \( sp^{3} \) מתחבר דרך \( sp^{2} \). כל זה עוזר להבין אחרי זה כימיה אורגנית.
אוקיי, מודל נוסף לקישור זה מודל חכם שהוא נקרא Molecular orbital theory (MO). מה מיוחד במודל הזה? א׳, המודל הזה נותן לך קישור מתוך נקודת מבט של אורביטלים של מולקולה. מה שיפה במודל הזה כמה דברים. א׳, הוא יכול לנבא חוזק של מולקולות. זה מודל שיכול להגיד לך אם מולקולה יכולה בכלל להיות, והוא יכול להגיד לך בין כמה מולקולות איזו תהיה יותר יציבה. אז יש לו יכולת לתת לך פרמטר חשוב של יציבות של מולקולה.
כל המודלים שנתתי עד עכשיו לא אמרו לכם מי יותר יציב מהשני. אתם לא יודעים אם אמוניה היא יותר יציבה ממימן, והאם מימן יותר יציב מחנקן. המודל הזה נותן לך א׳ יציבות. ב׳, הוא נותן לך גם לדעת לגבי כל מולקולה את הפרמטר המגנטי שלה - האם היא מגנטית או לא מגנטית. זה שני תכונות חשובות.
מה עובד העניין הזה? על מה הוא עובד? הדבר הזה עובד על אורביטלים של מולקולה. מה שאתה אומר: אתה אומר עכשיו כל אטום מגיע ובעצם לוקח אורביטל שלו עם האורביטל של האטום השני ויוצרים קומבינציה לינארית חדשה. יוצרים אורביטל מולקולרי. אם הם באים כאורביטלים אטומיים הם מערבבים ביניהם את האורביטלים ויוצרים קומבינציה חדשה. הקומבינציה החדשה הזאת היא אורביטל של המולקולה, לא של האטומים הבודדים. אבל כפי שאתם יודעים, כשאנחנו לוקחים גלים, אז אם אנחנו מחברים את הגלים יכול להיות לנו התחברות בונה והתחברות הורסת.
אם היא בונה והורסת, אז גם כאן זה גלים. המולקולות מגיעות כגלים והן מתחברות. הן יכולות ליצור קשר שנקרא ״קושר״ ו״לא קושר״. אז כל העיקרון זה ליצור אורביטלים מולקולריים. אוקיי? מתוך האורביטלים המולקולריים האלה אתה יוצר רמות אנרגיה. מתוך רמות האנרגיה האלה אתה ממלא את השיבוץ האלקטרוני ואתה יכול לעשות את כל החישובים. אז בעצם מה שאתה עושה: אתה לוקח שני אטומים, פעם אחת אתה עושה להם התאבכות בונה - אתה מקבל פס אחד אורביטל בונה. פעם אחת זו התחברות הורסת - כאילו זו הפחתה ביניהם. אתה מקבל את האורביטל הלא קושר.
בואו ניקח את זה כדוגמה. זה באמת מודל הכי חדשני ונוח מאוד. בואו ניקח למשל אם אני לוקח אורביטלי \( s \) של מולקולה מסוימת, נניח אני רוצה לקחת מימן. רק במימן. אז אני אומר במימן כל אחד מהאטומים מגיע עם אורביטל \( s \). אז אורביטל \( s \) של מימן אחד ואורביטל \( s \) של מימן השני יוצרים קומבינציה בונה. אני לוקח את האורביטל הזה והאורביטל הזה יוצר קומבינציה בונה. הקומבינציה הבונה נקרא לה \( \sigma \), קשר \( \sigma_{1s} \). הוא יציב באנרגיה ויש לי חפיפה. מיד אני אראה לכם גם איך מראים את זה.
אבל מצד שני, הם יכולים לחפוף בצורה שתיצור שהם out of phase, כי זה פונקציות גל. אז אם הן יוצרות out of phase, הן ייצרו קישור לא קושר - אנטי-בונדים, ונוצר גם אורביטל שהוא לא קושר. נסמן אותו \( \sigma_{1s}^{*} \) לא קושר עם קו מעל. הוא באנרגיה יותר גבוהה מהם, הוא לא חופף ביניהם, הוא לא גורם לאלקטרונים לנוע בשבין הקשר אלא הוא מונע מהם לנוע. הם לא יוצאים להיות פה. איך אנחנו נראה את הדבר הזה גרפית?
נראה את הדבר הזה גרפית בצורה הבאה: אני לוקח אורביטל של \( 1s \) של כל אטום. אני יוצר אורביטל אחד קושר שהוא \( 1s \), ואורביטל אחד לא קושר שהוא \( \sigma_{1s} \) לא קושר עם פוחד, וכאן \( \sigma_{1s}^{*} \). אז בעצם הם באים אורביטל אחד מגיע \( s \) נכון \( 1s \), וכאן יש לו \( 1s \). כל אחד מגיע עם אלקטרון אחד בו, ועכשיו אני אומר אוקיי: אני יוצר אורביטל אחד שהוא קושר באנרגיה. זה נקרא אורביטל \( \sigma \). ואני יוצר אורביטל לא קושר באנרגיה שהוא עולה באותה צורה. הוא לא יציב, הוא לא קושר אנרגטית.
עכשיו זהו. אין לי יותר את האורביטלים האטומיים של האטומים אלא אורביטלים של המולקולה. ועכשיו אני שם את המימנים. אחד ייכנס פה, השני ייכנס כאן, וזה האורביטל המולקולרי. ואני אומר כעת שהמולקולה של מימן זה \( \sigma_{1s} \), שני אלקטרונים. זה לגבי מימן. כעת אני אומר שהמולקולה הזאת נמצאת באורביטל \( \sigma_{1s} \), שני אלקטרונים. בסדר?
לא הבנתי. אה, כי תמיד הם ילכו לאנרגיה נמוכה ביותר. אלקטרונים תמיד ירצו להיות ברמה נמוכה ביותר. יפה. יכול להיות מצב שיש יותר אלקטרונים והחלק ילכו ללא בונה, ואז המולקולה לא יציבה. תכף תבין. אבל למה נמשכים למטה? כי תמיד, כשמסדרים אלקטרונים, מסדרים באורביטל הנמוך ביותר.
אה, זה מתמטי. מתמטי. כל אורביטל אתה לוקח \( s \) ו-\( s \) מחבר: בונה, לא בונה. תמיד אוטומטית, לקחת שני אורביטלים, אתה תיצור שני אורביטלים מולקולריים - אחד בונה, אחד לא בונה. אם אתה לוקח שלושה \( p \) ושלושה \( p \), אז כמה אורביטלים תיצור? תכף נגיע לזה. שישה.
סדר קשר
אוקיי, אז עכשיו בואו נראה למה המודל הזה הוא מצוין. יש לכם דבר שנקרא סדר קשר (Bond order - BO). ושימו לב, סדר הקשר הוא שקובע את חוזק המולקולה. סדר הקשר ניתן על ידי:
(מספר האלקטרונים באורביטלים הקושרים - מספר האלקטרונים באורביטלים הלא קושרים) / 2
זה דבר שנקרא סדר קשר. לפי הדבר הזה, בואו נחשב למולקולה הזאת. מה סדר הקשר פה? כמה יש בקושרים? אין אורדר. יש לי שניים. פחות כמה יש לי בלא קושרים? אין בכלל. לא בלא קושרים. אין אלקטרונים, נכון? שניהם נכנסו הכי נמוך. פחות אפס חלקי שתיים. אז זו מולקולה שסדר הקשר שלה הוא אחד.
אם הייתי מקבל מולקולה עם סדר קשר שלוש, מי יותר יציב? שלוש. ככל שסדר הקשר שלך יותר גבוה, אתה יציב יותר. אבל זו מולקולת סדר קשר אחד. אוקיי. אם היה יוצא לי סדר קשר אפס, האם המולקולה הזאת קיימת? לא. אין לה יציבות. לא שווה לי לעשות שום דבר. זה אפס. אז זו מולקולה שסדר הקשר שלה הוא אפס. הן לא יציבות. הן לא קיימות.
כן, בדיוק. בדיוק. ככל שאתה יותר יציב, זה אומר שאתה פחות מתפרק. קשה יותר לפרק אותך ביחס למולקולה אחרת. אתה משווה. אתה רק... בדיוק. המספרים לא אומרים לך כלום. אם זה אפס, אתה יודע שזה לא קיים. אבל אם זה אחד ושלוש, אתה יכול לדעת. אבל בין ארבע מולקולות שאחת מהן אתה לא יכול לדעת מי מהן יותר יציבה.
אז אם אנחנו מסתכלים על זה, אנחנו יכולים לעשות כל מיני מולקולות. וכאן יש כבר טבלה של כל מיני מולקולות. שאני עושה. בואו ניקח, למשל, את המולקולות הליום ונעשה אותה ביחד. אוקיי? בואו נעשה את המולקולות הליום ונראה אם קיימת מולקולה כזאת שהיא הליום שתיים. הליום שתיים קיימת? לא. אין דבר כזה הליום שתיים. זה גז אציל. הוא מגיע לבד. בואו נראה למה הוא לא מגיע.
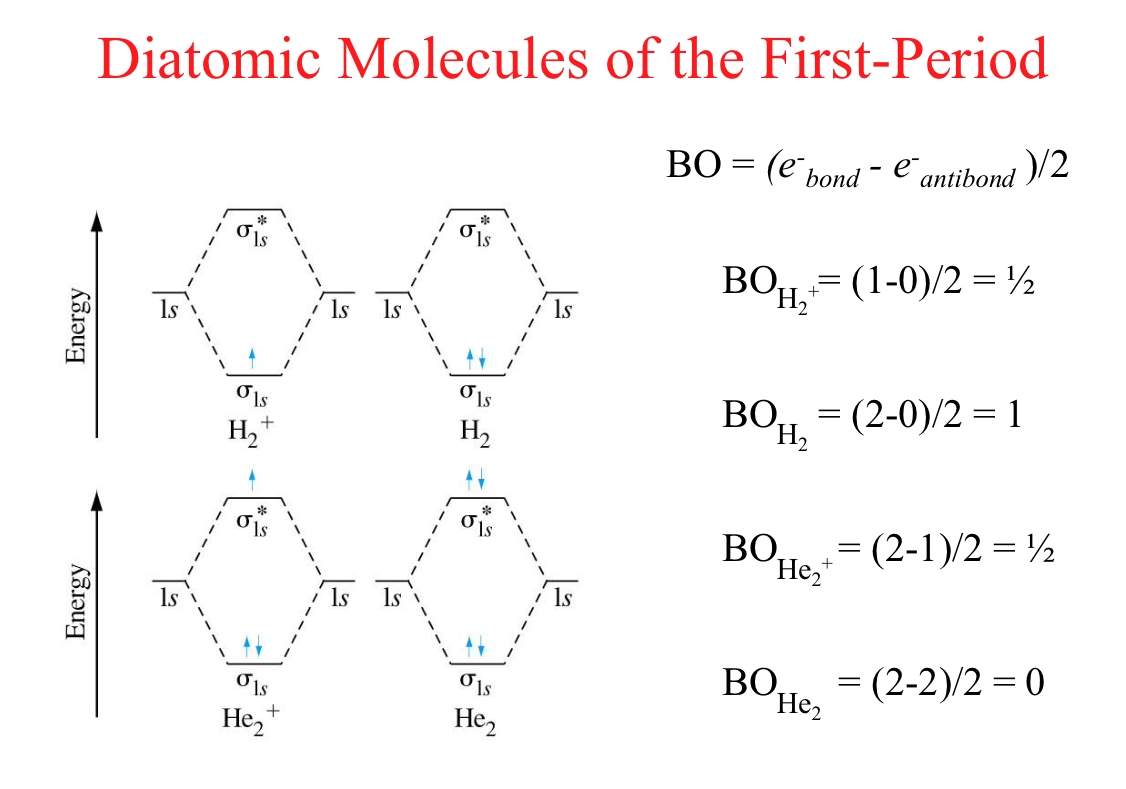
רוצה? יפה. הליום מגיע כל אחד עם כמה? הליום, כל אחד מגיע עם כמה אלקטרונים? שניים. \( 1s \). הליום, כל אחד מגיע עם שני אלקטרונים. מסכימים? גם זה הליום. עכשיו הם יוצרים קומבינציה. זה \( 1s \) של הליום ו-\( 1s \) של הליום. הם יוצרים קומבינציה בונה, שזה S1 + S1, יוצר את הקומבינציה הבונה שזה \( \sigma_{s1} \). אבל S1 - S1, שזה ההורס, נותן \( \sigma_{s1}^{*} \) כוכב.
עכשיו יש לי פה \( \sigma \) כוכב. ועכשיו בואו נסדר את כל האלקטרונים באורביטלים. למטה הדבר הראשון ייכנסו שניים, ויש לי ארבעה אלקטרונים. אז עוד שניים פה. עד לכאן בסדר? אז את כל האלקטרונים שהיה לי ברמת האטום הכנסתי לאורביטל המולקולרי. יפה. אז ארבעה ייכנסו.
מה עשיתם? למה? עוד פעם, אתה מתחיל באורביטלים. בסדר? אורביטלים של כל אטום שהוא מגיע. המימן מגיע עם כמה? הליום מגיע עם כמה אורביטלים? אחד. איזה אחד? איזה אחד? \( s \). איזה אחד. \( s \). איזה אחד. כמה אלקטרונים יש לו שם? עולה. אתם אלופים. והמימן השני, ההליום השני מגיע עם מה?
עכשיו אמרתי שמתמטית, מה שאני עושה, אני לוקח ויוצר אורביטל של המולקולה. אני לוקח אורביטל, פונקציית גל של פסא יחד \( s \) ועוד פסא יחד \( s \), זה יוצר התאבכות בונה שיוצרת את אורביטל שקוראים לו \( \sigma \). בסדר? זה התאבכות בונה. ה\( \sigma \) הזאת יציבה. היא יותר טובה מכל אחד מה-\( s \)-ים, אז היא יורדת באנרגיה. עד לכאן בסדר? אם יש כאן אנרגיה, כאן יש טבלה של אנרגיה, היא יורדת באנרגיה. אני מסמן את זה בירידה באנרגיה. הנה \( \sigma \).
אבל... אני לוקח פסא יחד \( s \), פחות פסא יחד \( s \), כלומר התאבכות הורסת, ואני מקבל אורביטל שהוא לא קושר. נכון? שהוא גבוה יותר באנרגיה, כי זו התאבכות הורסת. אני לוקח פסא יחד \( s \) מינוס פסא יחד \( s \) של האורביטל. זה לא קושר וזה עולה. אינה. מה? כי הוא לא יציב באנרגיה. הוא לא קושר. הקושר נותן לך.
זהו. הוא עשה התאבכות הורסת. מה הכוונה שהוא עשה התאבכות הורסת? אם יש לך התאבכות בונה שהאלקטרונים כעת יכולים לנוע, התאבכות הורסת זה אומר שהם לא יכולים לנוע בין הגרעינים. אין כאן קשר. אין אפשרות לנוע בין הגרעינים. זו התאבכות הורסת של גלים שהורידה לך את הגל. אם כאן הגל הפך להיות סכום שני הגלים של \( s \), וההתאבכות ההורסת הרסה את זה ובעצם באנרגיה זה מאוד גבוה.
האלקטרונים לא יהיו פה. הם לא רוצים להיות פה. אז זה גבוה באנרגיה ביחס לזה. אוקיי? עכשיו, שלב הבא. אתה אומר: יצרתי את המולקולה. לא מעניין אותי האטומים. זו המולקולה. עכשיו אני אעשה קו, הנה יש לי את האורביטל המולקולרי. ובואו נראה עכשיו כמה אלקטרונים היו לי באטום. היו לי ארבעה. אני צריך למלא אותם במולקולה, אז אני אשים שניים פה ושניים מנה.
בסדר? היו ארבעה, ועכשיו הכנסתי אותם לאורביטלים של המולקולה. בואו נחשב את הבונד אורדר, את הסדר. מה זה אומר הסדר? שווה. כמה יש לי בקושרים? שניים. פחות כמה יש לי בלא קושרים? שניים. חלקי כמה? שניים. מה קיבלתי? אפס. אפס. זו מולקולה קיימת? לא. אז לכן, המולקולה הליום שתיים אינה קיימת.
מה זה קיימים רק שניים? יש הליומים. -הליום ועוד הליום. לא.
לא, לא, אני עושה... אני יוצר אורביטלים מולקולה למולקולה \( \text{H}_2 \), אני יוצר את האורביטלים המולקולריים שלה. מה זה או ככה או ככה? לא, ברגע שיצרתי את... זה האטומי, כל אחד זה של האטום. ברגע שיצרתי את האורביטל המולקולרי זה MO, זה האורביטל המולקולרי.
לא, אני אומר, את לוקחת פונקציות גל, עצום. בואו תראו, מה שאתה עושה בעצם, אתה מתחיל משני אטומים. תראו כאן, תעקבו אחריי. יש שני אטומים. זה יכול להיות שני אטומים של מימן, זה יכול להיות שני אטומים של הליום. אני דבר ראשון מתחיל בתיאוריה שאומרת, אני עושה על התיאוריה, לא מעניין אותי כל אטום ומה הגיע. אני עושה קומבינציה לינארית, מחבר אורביטלים, חופף ביניהם, כדי ליצור אורביטל אחד קושר, שזה יהיה \( \sigma \). אני יודע שהוא נמוך באנרגיה ביחס למה שהם הגיעו, ויש לי עוד אורביטל אחד דמיוני שהוא לא קושר. עד לכאן בסדר?
יפה, עכשיו, ברגע שיצרת את האורביטל המולקולרי, לא מעניין אותך מה היה. את אומרת: היו לי פה אלקטרונים, בוא אני אכניס אותם למבנה הזה. אז שני אלקטרונים במימן הלכו אחד לפה ואחד לפה, וזה בסדר. אבל בהליום יש לי ארבעה. שתיים מגיעים לפה ושתיים מגיעים לפה, ואני מקבל שהסדר קשר הוא אפס, כלומר המולקולה הליום שתיים לא יכולה להתקיים. בעזרת המודל הזה הגעתי לזה שהיא לא יכולה להתקיים.
שנייה. דיברת עכשיו במקביל על הליום ועל זה עם שני דברים שונים. אז אני אסביר שוב, תראה. שתיים מגיעים לפה, ושתיים מגיעים לפה. וזה מגיע אלקטרון, נכון? בסדר? יצרתי את החצים האלה \( \sigma \), ו\( \sigma \) זה של המולקולה. אז הכנסתי אותם את שני אלה לפה, וקיבלתי סדר קשר אחד. זו מולקולה יציבה.
אם הייתי עושה, למשל, את המולקולה מימן פלוס אחד ( \( \text{H}^{+}_{2} \) ), מה זה מימן פלוס אחד? יפה. זה בדיוק כמו פה. היה אלקטרון אחד בודד, הוא נכנס. הנה. מה הסדר? הקשר חצי. זו מולקולה שקיימת. אבל... וזאת היא גם מולקולה שקיימת. לעומת זאת, המולקולה \( \text{He}_2 \), הליום שתיים לא יכולה להיות קיימת כי היא אפס. ואם תעשי הליום פלוס שתיים, את רואה שיש לך שתיים ואחד, אז זה שתיים ואחד, ותקבלי סדר קשר חצי.
איפה? באיזה מולקולה? , זה סביר, סבבה. קשר יציב. לא, ל-H+. ל-\( \text{H}^{+}_2 \). \( \text{H}^{+}_2 \) זה חצי. קיבלתי רק עם אלקטרון אחד. הוא בא. הנה. ו-\( \text{H}^{+}_2 \) פחות יציב מה-\( \text{H}_2 \). טוב, אנחנו נתקדם. הלאה.
אתה יכול לעשות את זה גם עם אורביטלים של \( s \) ו-\( p \). אני יודע שזה מורכב, אבל אני רוצה לגמור את זה היום ולהסיר מעלינו את הפרק הבא. עכשיו, לא חייבים לעשות את זה רק עם אורביטלי \( 1s \). יש אטומים שמגיעים גם עם אורביטלי \( 2s \) ו-\( 2p \). לדוגמה, אם אני לוקח את המולקולות שמגיעות ב-\( p \), גם ב-\( p \) אתה יכול לעשות קומבינציה לינארית. רק שב-\( p \) יש לך כמה אורביטלים שאתה יכול ליצור.
ב-\( p \) אתה בעצם יכול ליצור חפיפה על ה-X. זה ייצור. יש לך... אוקיי. עכשיו, בואו נדבר על אורביטלי-\( p \). באורביטלי-\( p \) יש לי שלושה אורביטלים שאני צריך לערבב. בעצם זה שישה, אז אני אצור שישה אורביטלים. אם אני לוקח עכשיו אטומים שיש להם אורביטלי-\( p \), תקשיבו-נה, אורביטלי-\( p \). אם זה אורביטלי-\( s \), זה קל, כי יש לי \( s \) ו-\( s \), אז אני יכול לקבל \( 1s \) קושר, \( 1s \) לא קושר. גם אם הייתי עושה את זה באורביטלי-\( 2s \), אין בעיה, הייתי מקבל \( 2s \) קושר ו-\( 2s \) לא קושר.
מה קורה אם אני עושה את זה עם אטומים שמגיעים כבר עם אורביטלי-\( p \)? אוקיי, אורביטלי-\( p \). אז באורביטלי-\( p \) יכול להיות כמה דברים. אורביטלי-\( p \) שהם לאורך הקשר, שהם לאורך הקשר, הם יוצרים אורביטל שנקרא \( \sigma_{p} \) ולא קושר \( \sigma_{p}^{*} \). זה כשהחפיפה היא לאורך הקשר, אוקיי, לאורך האטומים. אם אתה עושה קומבינציה לאורך האטומים, זה מגיע עם X וזה מגיע עם X, והם יוצרים קשר לאורך האטומים, הם יכולים ליצור קשר שנקרא \( \sigma_{2p} \), או לא קושר שלהם, שאיזו התאבכות הורסת של שני אלה, יהיה לא קושר-\( \sigma^{*}_{2p} \). זה לגבי אם באת לאורך הקשר.
עכשיו, במקביל לקשר יש לך עוד שני אורביטלים, אז אתה יכול ליצור אורביטל שנקרא \( \pi_{2p} \) קושר ו\( \pi_{2p}^{*} \) לא קושר, ואתה יכול ליצור עוד פעם \( \pi_{2p} \) קושר ו\( \pi_{2p}^{*} \) לא קושר. בסך הכול, אתה יוצר שישה אורביטלים, כי באת עם שלושה של אטום אחד ושלושה של האטום השני, ערבבת אותם, יצרת שישה אורביטלים. שניים קושרים לאורך הקשר שהם נקראים σ, σ קושר ולא קושר, תמיד כשאתה עושה קומבינציה, יש לך קושר, לא קושר, ועוד שניים, אלה יהיו לאורך הזה ואלה יהיו לזה, מקבילים, יוצרים לשניים, קושר מסוג π או קושר מסוג σ, ולא קושר מסוג \( \pi^{*} \) ולא קושר מסוג \( \sigma^{*} \).
איך זה נראה על הנייר, אם אתם רוצים לראות את המבנה? המבנה נראה ככה. יש לך שלושה אורביטלי π, והם יוצרים לך איזשהו אורביטל σ קושר, \( \sigma_{2s} \) קושר או σ לא קושר, ואחרי זה שני π-ים ושני π-ים לא קושרים. שימו לב, זה סדר האנרגיה. σ יותר יציב, והπ יותר למעלה. וכמובן, אם יש לך שני \( s \)-ים, גם שני \( s \)-ים יהיו פה. אוקיי.
למשל, יש שני פחמנים. עכשיו, הסידור בין σ ל-\( s \) הוא מאוד מבלבל. איך הם מסתדרים? כאן אתם צריכים לזכור שעד לז׳ שהושבע, בערך שזה חנקן, המבנה הזה הוא המבנה המסודר, שσ הוא יותר יציב מπ. כשאתה עובר את ז׳ מעל שבע, כל ז׳ מעל שבע חנקן, חמצן ומעלה, מה שמתאפך זה שדווקא הπ-ים הופכים להיות יותר יציבים, והσ-ות פחות יציבים. אוקיי.
ברוקב, אבל אתם תלמדו את זה, זה לא מסובך כזה. ואז אתה יכול לעשות לכל מולקולה את המבנה שלה. למשל, בואו נעשה למולקולה, ואז אתה יכול לקבוע איזה סוג מולקולאי.
עכשיו, מבחינת מגנטיות, תכף אני אעשה את זה. אני יודע שזה מפחיד, אבל זה לא נורא. זה ממש כמו סודוקו או אם יודעים לעשות את זה, זה אפילו קל. עכשיו, לגבי מגנטיות, החומרים בטבע, יש שני סוגי חומרים. יש חומרים שנקראים די-המגנטיים. זה חומרים שאם אתה שם אותם בשדה חשמלי, בשדה מגנטי, לא קורה כלום. הם לא מושפעים מהשדה המגנטי. חומר שלא מושפע מהשדה המגנטי החיצוני, הוא נקרא חומר די-מגנטי. ולמה הוא לא מושפע מהשדה המגנטי? כי אין לו אלקטרונים לא משובצים.
אלקטרון זה מעין מגנט קטן. אם יש לי מגנט קטן שיכול להגיב עם המגנט החיצוני, אז אני ארגיש את השדה המגנטי. אבל ברגע שכל האלקטרונים שלי משובצים, אין לי מצב של אלקטרונים שהם לא משובצים, אז החומר הזה, אין לו, הוא לא יוצר מגנט קטן משלו, הוא לא מגיב לשדה המגנטי. אז כל פעם שכל האלקטרונים שלכם משובצים, אתה תהיה חומר די-מגנטי. חומר שלא מרגיש שדה חשמלי.
לעומת זאת, אם יש לך אלקטרונים לא מזווגים, אתה תהיה חומר פאראמגנטי. עכשיו, כשאני אכניס אותך לשדה מגנטי, אתה תימשך מאוד לשדה המגנטי. אתה מאוד תימשך לשדה המגנטי, כי יש לך אלקטרונים לא מזווגים, שהם משמשים כמגנטים קטנים לשדה המגנטי.
(a) \( \text{Z} \geq 8 \)
למשל, אם תסתכלו על מולקולה כמו C2, היא מולקולה שאם אני אעשה לה את כל השיבוץ, אין לה אלקטרונים, אבל לעומת זאת, B2, היא מולקולה עם שני אלקטרונים לא מזווגים, וזאת תהיה מולקולה פאראמגנטית. היא תרגיש שדה מגנטי.
לכן, אם אתה הולך למולקולות כמו O2, גם ב-O2, יש לך זוג אלקטרונים לא קושר, והזוג האלקטרונים הלא קושר הזה נותן לך ש-O2, למשל, זה מולקולה פאראמגנטית, היא נמשכת לשדה מגנטי. אבל בצורה הזאת, אתה מקבל כל מיני.
אורביטלים מולקולרים של \( \text{O}_2 \)
\( \text{BO}_{\text{O}_2} = \frac{8 - 4}{2} = 2 \)
עכשיו, גם אם תעשו, למשל, למולקולה O2, היא יותר יציבה מ-F2, שהקשר שלו הוא 1, ויותר יציבה מניאון, שהקשר שלו הוא 0. אבל בואו נעשה את זה פעם אחת עבור המולקולות הסופיות, אוקיי?
לפי הסידור המולקולרי, שתזכרו, עד שבע σ, ומשבע הσ מתחלף לדווקא הπ, הופכים להיות יותר משמעותיים, בסדר? אז בואו ניקח, למשל, ננסה לעשות עכשיו ל-C2, למולקולה C2, אוקיי? ננסה לעשות לה סידור, בסדר? את כל הסידור, מההתחלה עד הסוף, של האורביטלים המולקולריים. בסדר? נעשה את זה מההתחלה.
אורביטלים מולקולריים של \( \text{C}_2 \)
\( \text{BO}_{\text{C}_2} = \frac{6 - 2}{2} = 2 \)
אני מתחיל ככה. בואו נראה כל פחמן מגיע, עם מה מגיע כל פחמן. דבר ראשון, יש לנו שני אורביטלים ב-S1. בואו נעשה את זה יפה. עכשיו אתם צריכים קצת סבלנות. S1, S1 של פחמן אחד, ו-S1 של פחמן שני. מגיעים כל אחד עם זוג אלקטרונים.
S1 יוצר לי σ, \( 1s \), וσ לא קושר, \( 1s \). ושני אלקטרונים. אחד פה, אחד פה, אחד כאן, אחד כאן. אחרי זה \( 2s \), זוג אלקטרונים. אני לוקח כל פחמן. זה מייצג פה, הקו הזה, זה פחמן אחד שמגיע, והקו הזה זה פחמן שני. \( 2s \). וזה גם כניצור, לפי ההיגיון הפשוט שלנו. \( \sigma_{2s} \) קושר, ו\( \sigma_{2s} \) לא קושר.
וגם פה יהיו 2. עד לכאן בסדר? אוקיי, מה לא? הבנתם מה שעשיתי עם המימן?
כן הלאה יפול עכשיו אני הולך לעשות את זה עבור פחמן בואו נחשוב כמה פחמן מגיע מההיערכות של פחמן.
אורביטלי של פחמן אני רושם הנה אני אתחיל עם כולכם לאט. פחמן עם כמה הוא מגיע אחת \( s \) שני אלקטרונים נרשום אחת \( s \) שני אלקטרונים שתיים \( s \) שני אלקטרונים שתיים \( p_{x} \) שתיים \( p_{y} \) שתיים \( p_{z} \). כמה מגיע כל אחד מהם?
כמה קומבינציות? שתשובה זה יפה. כמה אלקטרונים יש לפחמן? שתיים מגיעים באחת \( s \), נכון? שתיים מגיעים בשתיים \( s \) וב-\( p \) מגיע אחד ואחד. מסכימים את זה?
רגע רגע, אחד ואחד. עד לכאן בסדר. עכשיו אני אומר אני רוצה לעשות קומבינציה בין פחמן אחד לפחמן שני. הנה זה פחמן אחד שמגיע עם האורביטלים האלה, וזה פחמן שני שמגיע עם אותם אורביטלים: אחת \( s \) שניים, שתיים \( s \) שניים, שתיים \( p_{x} \), שתיים \( p_{y} \), שתיים \( p_{z} \), אחד, אחד. מסכימה?
בואו נתחיל. דבר ראשון לחשוף את האורביטליה \( s \) שלהם. מותר לי? יופי. אני יורד על הברכיים. שימי לב, מתחיל באחת \( s \) ואחת \( s \). אחת \( s \) כמה אלקטרונים יש פה? שתיים. עונקן שתיים.
אחת \( s \) עם אחת \( s \) יוצרים קושר \( \sigma \). איך נקרא על הקושר הזה? \( \sigma_{1s} \) כי הוא בא מאחת \( s \), נכון? ויוצרים את הלא קושר \( \sigma_{1s}^{*} \) (עם כוכב מעל).
עד לכאן בסדר? עולה טיפה. שתיים \( s \), יש גם שתיים \( s \), אפילו עולה טיפה יותר. שתיים \( s \) מגיע עם שני אלקטרונים. שתיים \( s \) מגיע עם שני אלקטרונים, נכון? כשאני מחבר שתיים \( s \) עם שתיים \( s \), מה אני מקבל? \( \sigma_{2s} \) קושר ו\( \sigma_{2s}^{*} \) לא קושר. הטריבונה נהנית שאני מטפטל פה והם צוחקים. אני אוהב את זה.
\( \sigma_{2s} \) ו\( \sigma_{2s}^{*} \). כאן אני אשים שני אלקטרונים, וכאן שני אלקטרונים. עד לכאן בסדר?
דרך אגב, אם מבקשים ממך רגע, עוד לא. יש לנו את הפאים. יפה, אבל יש לנו עוד פאים. עוד לא סיימנו עם הפאים. כי עכשיו יש מולקולה כבר, אין אטומים בלבד. הבנתם? עכשיו אם הייתם צריכים לרשום את הדבר הזה, אם הייתם צריכים לרשום כי במבחן אומרים "רשום מערכות אלקטרונית", אז הייתם רושמים ככה:
אחת \( s \) אחד, שתיים שתיים. אחת S* שתיים, שתיים \( s \) שתיים. אם הייתי צריך לרשום אורביטלי מולקולרים למולקולה הזאת עד לכאן, הייתי אומר: אחת \( s \) שני אלקטרונים, אחת S* שני אלקטרונים, שתיים \( s \) קושר שני אלקטרונים, שתיים S* לא קושר שני אלקטרונים.
בסדר? ממשיך הלאה. מוחק עם יד אחת. שימו לב, מוחק. אבל מה נשאר לנו, ילדים יקרים? נשאר לנו אורביטלי \( p \), נכון? נשאר לנו אורביטלי \( p \). כמה יש להם? שלושה, נכון? הנה \( p_{x} \), \( p_{y} \), \( p_{z} \). וגם פה יש לי \( p_{x} \), \( p_{y} \), \( p_{z} \). זה אורביטלי \( p \) שיש עדיין לכל פחמן.
קשרתי אותם כאן. זה בוצע קישור לאורביטלי \( s \) ושתיים \( s \). עד לכאן זה בסדר. עכשיו נשאר להיות \( p \). בכל \( p \) פה יש לי אלקטרון, אלקטרון, וכאן יש לי אלקטרון, אלקטרון. עד לפה בסדר?
יופי, בשעה טובה. מה שאני אומר כעת: אני יוצר קישור שהוא קישור אנרגטי. עכשיו, איך האורביטלים האלה מגיבים? שלושת האורביטלים האלה מגיבים ככה...
כשאתה עושה יש לך שלושה אורביטלי \( p \) בכללי, הם יכולים ליצור שלושת האורביטלים האלה ככה: אורביטל שהוא נקרא \( \sigma_{p} \) קושר וσ-P* לא קושר. זה אורביטל נניח שה-\( p_{x} \)ים זה לאורך הקשר. נניח שזה ה-\( p_{x} \)ים. אז אם זה לאורך הקשר של בין הפחמן לפחמן, אז אם זה לאורך הקשר קוראים להם σ, ואז נשאר להיות אורביטל \( p_{y} \), \( p_{z} \). את ה-\( p_{y} \) וה-\( p_{z} \) שאני קושר הם נקראים π, ויש לי שניים כאלה.
שניים π ועוד שניים π*. זה יוצר את הלא קושר שלהם: שניים π-P ושניים π-P*.
והיווצר לי עוד אחד כאן. במקרה הזה שש זה σ קושר של \( p \) ויעלה מעליו σ לא קושר של \( p \), σ-P*. עכשיו רגע, כמה אלקטרונים היו לך פה? היה לך אחד ואחד, וגם פה אחד ואחד, נכון?
אז הם הלכו לפה: אחד, שניים הלכו הנה, ושניים הלכו הנה. אז כלומר אם אני מסתכל עכשיו על פחמן ואני עושה את כל הסידור שלו מההתחלה, אני אומר ככה:
הסידור שלו היה לו \( \sigma_{1s} \) שני אלקטרונים, \( \sigma_{1s}^{*} \) שני אלקטרונים, \( \sigma_{2s} \) שני אלקטרונים, \( \sigma_{2s}^{*} \) שני אלקטרונים, ואחרי זה \( \pi_{2p} \) שני אלקטרונים, ו\( \pi_{2p}^{*} \) עוד שני אלקטרונים. זה הסידור שלו.
ובואו נעשה לו... אני תכף זמן, נעשה לו סדר קשר. סדר הקשר שלו ככה: כמה יש לו בקושרים? שתיים, ארבע, שש, שמונה. נכון? שתיים, ארבע, שש, שמונה. שמונה בקושרים. לא קושרים יש לו שתיים, נכון? ארבע. שמונה מינוס ארבע חלקי שתיים. סדר הקשר שלו הוא שתיים.
שאלות? בסוף רגע. צ'ל, כן?
מספר שאחרי זה יכול להגיד לך למשל עם חנקן יותר רציב ממנו כן נכון או P או סיגמא תמיד יהיו כל אלה תמיד ייווצר לך אחד סיגמא ושני P אבל הסדר שלהם מיותר רציב הסיגמא או הפי זה תלוי באיזה מספר בדיוק לא משנה זה יכול להיות בכל אחד מהם זה זה אם זה מעל שבע סיגמא למטה אם זה מתחת לשבע ה\( \pi \)ם למטה והסיגמא למעלה מה
יפה עכשיו כדי למשל נקודה אחרונה בנושא הזה זה הנקודה מה קורה אם יש לך הטרו אטומים אם יש לך הטרו אטומים אטומים שהם שונים כאן עשיתי למשל מימן מימן חנקן חנקן פחמן פחמן וכדומה אבל יכול להיות לך מולקולה ציור בגלל שיש לך מולקולות שהן זרעות שונות אז מה שאתה עושה אתה לוקח את האורביטלים ולפי אלקטרונגטיביות מולקולה אלקטרונגטיביות אתה לא מתחיל באורביטלים באותו סדר אתה מורי טיפה המולקולה שיותר אלקטרונגטיבית האורביטלים שלה יותר נמוכים ביחס לשנייה חמצן יותר אלקטרונגטיבית מפחמן אתה מקבל אורביטלים שהם טיפה מעוותים כי האס יותר רציב וגם כאן אתה עושה את כל הסידורים ומחשב סדר קשר למשל אפשר לחשב סדר קשר לסיור אפשר לנו ואתם רואים למשל סיור יוצא לך סדר קשר שלוש או יוצא לך שתיים וחצי לכן שאתה יודע שאם יש לך מולקולת אנו וסיור מי יותר יציב סיור זה סידור מולקולרי בעזרת אורביטלים מולקולרים
שנייה טוב אני אבטר לכם על הטרי מולקולות לא צריך את זה לבחינה שזה שלושה ושונים כן שונים כן אבל לא שלושה ומעלה שאלות כן שהם באורביטל לא קושר באורביטל כוכב כן כן אני מקשיב ואני כן כן למה אם מישהי שואלת שאלה בוא נהיה שנייה בשקט אולי היא שואלת משהו שבעניין אותכם ואולי יש לי תשובה מה לא הבנת לא
מההתחלה עד הסוף כן באופן עקרוני את אחד S ושתיים S את לא צריכה לחשב כי זה פלוס שתיים מינוס שתיים פלוס שתיים מינוס שתיים הם לא תורמים נכון הרי רק האחרונים תורמים בחשבון אחד S אם הוא מלא וזה זה נותן אפס וגם שתיים S אם הם מלאים זה אפס כי זה קושרים לא קושרים באותה מידה אבל שעושים את הסידור עושים את כולו
רוצים שנעשה לקראת ציום מולקולה אחת ביחד יופי כן שואלים אותך מה יציבות המולקולה אם שואלים אותך מה יציבות המולקולה צריכה אורביטל מולקולר אורביטל אז לא הבנתי לא הבנתי אז אז אז יש יפה לא מתי מחליטים ככה וכך זה הכל בהתאם למה את רוצה לדעת יש השאלה שנשאלה פה מתי אתה מחליט על היברידיזציה מתי אתה מחליט על אורביטלי מולקולרים ומתי אתה מחליט על זה כל פעם בהתאם לשאלה שאת נשאלת אם נותנים לך שני מולקולות ואמרו לך כיף אם יהיה מולקולה יציבה אין לך ברירת לעשות אורביטל מולקולה אורביטלים לעשות לכל אחד מהם ולחשב את הסדר קשר ככה תדעי לעומת זאת אם ישאל אותך מה הגיאומטריה וההיברידיזציה על האטום אז אתה צריכה לעשות גיאומטריה ולקבוע אם זה sp2 או sp3 אז רק לפי השאלה אין לך דרך אחרת לדעת מה לעשות
בואו נתן לכם נעשה נעשה איזה תרגיל עכשיו על כל מה שלמדנו כאן מההתחלה עד הסוף אז אני מוחק גם את זה גם את זה אני הופך ללוח ואני יש לכם עכשיו איזה 25 דקות לענות מתרגול של מסתאי על הנושא הזה בואו נראה מה אנחנו עושים נעשה ועביר גם את זה למסך כתיבה ועכשיו אנחנו נעשה תרגול של מבנים מסוימים, מבנה לואיס מסוימים ונקווה לגבייהם את כל מה שצריך. האם יש מתנדב אמיץ שרוצה להגיע ללוח רגע אני רק עונה פה למישהו
טוב טוב בואו ניקח בואו נראה את כל הדרך וגם מבנה לואיס את ההיברידיזציה שלו אוקיי וגם היברידיזציה ואולי נעשה גם מבנה גם מבנה איזה בואו ניקח את החומר בואו נראה איזה חומר אני אבחר לכם שנייה חומר שיכול להיות קצת מעניין קצת מאתגר בואו את המולקולה הזאת תקווהו את ההיברידיזציה הנה נותנים לכם שאלה המולקולה הזאת פחמן דוג אופריטי מבקשים ממכם ראשית קווה מבנה לואיס שנית קווה את ההיברידיזציה על האטום המרכזי
אוקיי קלה קלה. להתחיל כן תתחילו תקחו דקה שתיים לעשות מבנה לואיס וההיברידיזציה על האטום המרכזי מה האטום המרכזי פה לדעתכם אז אתם צריכים לעשות גם להגיד לי מהי הברידיזציה של האטום המרכזי ואתם צריכים לעשות מבנה לואיס לדבר הזה אללה טריבול אני מגיע נהיה שקט זה כמו קיטת מבר שאני מבסוטי אללה כיף להם שם מאחורה אבל במבחן הסופי אנחנו נצחק כן זה יחסית קל חבר'ה
אני רוצה את המבנה של המולקולה את מבנה לואיס שלה מבנה הכללי שלה ואת ההיברידיזציה על הפחמן המרכזי טוב אני מתחיל שנייה נתחיל לפתור את זה שואלים שנייה דקה מה כן טוב למה חזורית כן בעיקרון הטורי עזור לך לדעת כמה אלקטרונים מגיעה איתו כי פחמן מגיעה עם שישה אלקטרונים למה לא לא אבל זה שלוש ארבע ברמה הזאת ויש לו עוד שניים ב-S בעצם תעשי לגופרית כמה יש בקצה צריכה לראות כמה יש לו בסוף תעשי לו את הירחות האלקטרונים של זה זה אחד S שניים שניים S שניים ושניים P שניים נכון
לא אז אני שואלת למה הוא קדימה P אם יש לו קדימה בקדימה P טוב תעשי לו סידור לזה אחד S שניים כן שתיים S שתיים ופי יש לו שניים בפי P פי ווי ווי שני שני P זד בכל אחד אחד אז זה כדי להגיע נכון בכל אחד אחד אז סך הכל כמה אלקטרוני ערכיות יש לו שתיים כמה יש לו שתיים ארבע הוא מגיע עם ארבעה אלקטרוני ערכיות נכון כן